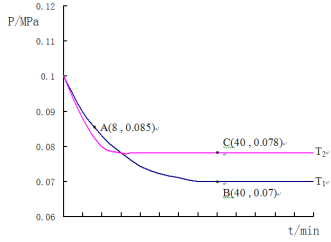
题目内容
【题目】二氧化硅是一种化工原料,可以制备一系列物质。下列说法正确的是( )
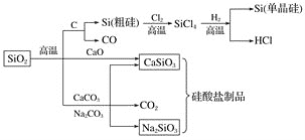
A.图中所有反应都不属于氧化还原反应
B.硅酸盐的化学性质稳定,常用于制造光导纤维
C.可用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸钙
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
【答案】C
【解析】
A. 化学反应前后有元素化合价变化的一定是氧化还原反应,二氧化硅与碳反应生成硅单质的反应是氧化还原反应,故A错误;
B. 光导纤维的成分是二氧化硅,不是硅酸盐,故B错误;
C. 碳酸钙溶于盐酸生成氯化钙和水以及二氧化碳,二氧化硅和盐酸不反应,可以用盐酸除去石英(主要成分为SiO2)中混有的少量碳酸钙,故C正确;
D. 玻璃是由纯碱、石灰石和石英制成的,玻璃属于混合物,没有固定的熔点,故D错误;
故选:C。

练习册系列答案
相关题目
【题目】由下列实验及现象推出相应结论正确的是
选项 | 实验 | 现象 | 结论 |
A | 某溶液中加入Ba(NO3)2溶液,再加足量盐酸 | 先有白色沉淀生成,加盐酸后白色沉淀不消失 | 原溶液中有SO42- |
B | 将湿润的淀粉碘化钾试纸放在盛有红棕色气体的集气瓶口 | 试纸变蓝 | 红棕色气体为溴蒸气 |
C | 将碳酸钠与盐酸反应产生的气体通入盛有硅酸钠溶液的烧杯中 | 烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
D | 将0.1mol/LMgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol/LCuSO4溶液 | 先有白色沉淀生成,后转变为蓝色沉淀 | 溶解度:Cu(OH)2<Mg(OH)2 |
A.AB.BC.CD.D