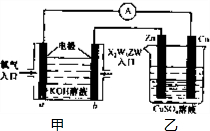
题目内容
m、n、x、y四种主族元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则:
(1)元素n的气态氢化物的电子式为______
(2)m与y所形成的化合物含______键
(3)x的原子结构示意图为______
(4)由n、y的氢化物相互作用所生成的物质的化学式为______.

(1)元素n的气态氢化物的电子式为______
(2)m与y所形成的化合物含______键
(3)x的原子结构示意图为______
(4)由n、y的氢化物相互作用所生成的物质的化学式为______.

m、n、x、y四种主族元素,它们的原子序数总和为46,平均原子序数为
=11.5,由4种元素在周期表里的相对位置可知,m、n处于第二周期,x、y处于第三周期,令n的原子序数为a,则m的原子序数为a-1,x原子序数为a+9,y原子序数为a+10,则a-1+a+a+9+a+10=46,解得a=7,则m为C、n为N、x为S、y为Cl,
(1)元素n的气态氢化物为NH3,其电子式为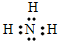 ,故答案为:
,故答案为: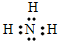 ;
;
(2)m与y所形成的化合物为CCl4,含极性键,故答案为:极性;
(3)S的原子结构示意图为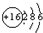 ,故答案为:
,故答案为: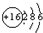 ;
;
(4)由n、y的氢化物相分别为NH3、HCl,互作用所生成的物质的化学式为NH4Cl,故答案为:NH4Cl.
| 46 |
| 4 |
(1)元素n的气态氢化物为NH3,其电子式为
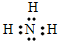 ,故答案为:
,故答案为: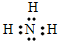 ;
;(2)m与y所形成的化合物为CCl4,含极性键,故答案为:极性;
(3)S的原子结构示意图为
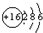 ,故答案为:
,故答案为: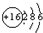 ;
;(4)由n、y的氢化物相分别为NH3、HCl,互作用所生成的物质的化学式为NH4Cl,故答案为:NH4Cl.

练习册系列答案
相关题目
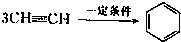 三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:______.
三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:______.