题目内容
A.已知A、B、C、D、E是短周期中的五种元素,它们的原子序数依次增大.A和B可形成常见化合物BA4,一个BA4分子中电子总数为10;C原子的最外层电子数是核外电子总数的
;D与C同一主族,E-比C2-多一个电子层.试回答:
(1)D与E两元素相比较,非金属性较强的是______(填元素名称),请你自选试剂设计实验验证该结论(说明试剂、简单操作、实验现象)______;
(2)A、C、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子且甲有18个电子,乙有l0个电子,则甲与乙反应的离子方程式为______;
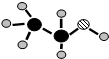
(3)由A、B、C三种元素组成的化合物的球棍结构如图:,试写出利用植物秸秆生产这种物质的化学方程式______、______.
| 3 |
| 4 |
(1)D与E两元素相比较,非金属性较强的是______(填元素名称),请你自选试剂设计实验验证该结论(说明试剂、简单操作、实验现象)______;
(2)A、C、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子且甲有18个电子,乙有l0个电子,则甲与乙反应的离子方程式为______;
(3)由A、B、C三种元素组成的化合物的球棍结构如图:,试写出利用植物秸秆生产这种物质的化学方程式______、______.

A、B、C、D、E是短周期中的五种元素,它们的原子序数依次增大.A和B可形成常见化合物BA4,一个BA4分子中电子总数为10,分子中5个原子的平均电子数为2,故A为H元素、B为碳元素;C原子的最外层电子数是核外电子总数的
,D与C同一主族,则C处于第二周期、D处于第三周期,令C的最外层电子数为x,则
×(2+x)=x,解得x=6,则C为氧元素、D为硫元素;E-比C2-多一个电子层,则E为Cl元素,
(1)同周期自左而右非金属性增强,故非金属性Cl>S;
将Cl2通入Na2S溶液(或氢硫酸)中,有浅黄色沉淀生成,说明Cl的非金属性比S强,
故答案为:氯;将Cl2通入Na2S溶液(或氢硫酸)中,有浅黄色沉淀生成,说明Cl的非金属性比S强;
(2)A、C、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子且甲有18个电子,乙有l0个电子,则甲为HS-、乙为OH-,二者反应的离子方程式为:HS-+OH-═S2-+H2O,
故答案为:HS-+OH-═S2-+H2O;
(3)由H、C、O三种元素组成的化合物,由球棍结构可知,黑色球为碳原子、小黑色球为氢原子、斜线球为氧原子,该化合物为CH3CH2OH,植物秸秆主要为纤多糖维素,纤维素水解生成葡萄糖,葡萄糖分解生成乙醇与二氧化碳,反应方程式为:(C6H10O5)n+nH2O
nC6H12O6,C6H12O6
2CH3CH2OH+2CO2↑,
故答案为::(C6H10O5)n+nH2O
nC6H12O6;C6H12O6
2CH3CH2OH+2CO2↑.
| 3 |
| 4 |
| 3 |
| 4 |
(1)同周期自左而右非金属性增强,故非金属性Cl>S;
将Cl2通入Na2S溶液(或氢硫酸)中,有浅黄色沉淀生成,说明Cl的非金属性比S强,
故答案为:氯;将Cl2通入Na2S溶液(或氢硫酸)中,有浅黄色沉淀生成,说明Cl的非金属性比S强;
(2)A、C、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子且甲有18个电子,乙有l0个电子,则甲为HS-、乙为OH-,二者反应的离子方程式为:HS-+OH-═S2-+H2O,
故答案为:HS-+OH-═S2-+H2O;
(3)由H、C、O三种元素组成的化合物,由球棍结构可知,黑色球为碳原子、小黑色球为氢原子、斜线球为氧原子,该化合物为CH3CH2OH,植物秸秆主要为纤多糖维素,纤维素水解生成葡萄糖,葡萄糖分解生成乙醇与二氧化碳,反应方程式为:(C6H10O5)n+nH2O
| 催化剂 |
| △ |
| 一定条件 |
故答案为::(C6H10O5)n+nH2O
| 催化剂 |
| △ |
| 一定条件 |

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目