题目内容
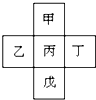
五种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
请回答下列问题:
(1)请写出元素名称:X______Y______W______
(2)元素Z位于周期表中第______周期______族;
(3)元素Z可以形成多种单质,其中最常见两种名称分别是______和______;
(4)Y的最高价氧化物的化学式为______;M的最高价氧化物水化物名称为______.
(5)W和Y形成的一种化合物,相对分子质量在170~190之间,且W的质量分数约为70%.该化合物的化学式为______.
| X | Y | ||
| Z | W | M |
(1)请写出元素名称:X______Y______W______
(2)元素Z位于周期表中第______周期______族;
(3)元素Z可以形成多种单质,其中最常见两种名称分别是______和______;
(4)Y的最高价氧化物的化学式为______;M的最高价氧化物水化物名称为______.
(5)W和Y形成的一种化合物,相对分子质量在170~190之间,且W的质量分数约为70%.该化合物的化学式为______.
这五种元素都是短周期元素,根据元素在周期表中的位置知,X和Y属于第二周期,Z、W、M属于第三周期,Z元素原子核外电子总数是其最外层电子数的3倍,设其最外层电子数是a,a+2+8=3a,a=5,所以Z是P元素,X是C元素,Y是N元素,W是S元素,M是Cl元素,
(1)通过以上分析知,X、Y、W分别是碳、氮、硫元素,故答案为:碳;氮;硫;
(2)Z是P元素,原子核外有3个电子层,最外层电子数是5,原子核外电子层数等于其周期数,主族元素的最外层电子数等于其族序数,所以P位于第三周期第VA族,故答案为:三;VA;
(3)Z是P元素,其单质有红磷和白磷,故答案为:红磷;白磷;
(4)Y是N元素,N元素最外层电子数是5,主族元素中其最高化合价数与其族序数相等,所以N的最高价氧化物是N2O5,M是Cl元素,Cl的最高价氧化物的水化物是高氯酸,其化学式是HClO4,
故答案为:N2O5;HClO4;
(5)W是S元素,Y是N元素,W和Y形成的一种化合物,相对分子质量在170~190之间,且W的质量分数约为70%,该化合物中W和Y元素的原子个数之比=
:
=1:1,其相对分子质量在170~190之间,设化学式为(SN)x,当x=4时,(32+14)×4=184,满足相对分子质量在170~190之间,故答案为:S4N4.
(1)通过以上分析知,X、Y、W分别是碳、氮、硫元素,故答案为:碳;氮;硫;
(2)Z是P元素,原子核外有3个电子层,最外层电子数是5,原子核外电子层数等于其周期数,主族元素的最外层电子数等于其族序数,所以P位于第三周期第VA族,故答案为:三;VA;
(3)Z是P元素,其单质有红磷和白磷,故答案为:红磷;白磷;
(4)Y是N元素,N元素最外层电子数是5,主族元素中其最高化合价数与其族序数相等,所以N的最高价氧化物是N2O5,M是Cl元素,Cl的最高价氧化物的水化物是高氯酸,其化学式是HClO4,
故答案为:N2O5;HClO4;
(5)W是S元素,Y是N元素,W和Y形成的一种化合物,相对分子质量在170~190之间,且W的质量分数约为70%,该化合物中W和Y元素的原子个数之比=
| 70% |
| 32 |
| 30% |
| 14 |

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目