题目内容
10.如图为某燃煤电厂处理废气的装置示意图,下列说法错误的是( )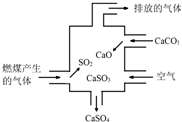
| A. | 使用此装置可以减少导致酸雨的气体的排放 | |
| B. | 该装置内既发生了化合反应,也发生了分解反应 | |
| C. | 总反应可表示为:2SO2+2CaCO3+O2→2CaSO4+2CO2 | |
| D. | 若排放的气体能使澄清石灰水变浑浊,说明该气体中含SO2 |
分析 A.二氧化硫是形成酸雨的重要物质;
B.碳酸钙受热生成氧化钙和二氧化碳的反应属于分解反应;二氧化硫与石灰水反应生成CaSO3和CaSO4是复分解反应和氧化还原反应;
C.根据反应过程可以书写反应的化学方程式;
D.能使澄清石灰水变浑浊.
解答 解:A.二氧化硫是形成酸雨的重要物质,经过处理后能减少酸雨的形成,故A正确;
B.碳酸钙受热生成氧化钙和二氧化碳的反应属于分解反应;二氧化硫与石灰水反应生成CaSO3和CaSO4是中和反应、化合反应,氧化还原反应,但没有置换反应,故B正确;
C.整个过程中,二氧化硫与碳酸钙和氧气反应生成了硫酸钙和二氧化碳,化学反应式可表示为2SO2+2CaCO3+O2=2CaSO4+2CO2,故C正确;
D.能使澄清石灰水变浑浊,不一定是二氧化硫,故D错误;
故选D.
点评 本题考查二氧化硫气体的污染和治理,解答本题要充分理解处理废气的过程,只有这样才能对相关方面的问题做出正确的判断.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.科学家最近发现两种粒子;第一种是只由四个中子构成的粒子,这种粒子称为“四中子”也有人称之为“零号元素”.第二种是由四个氧原子构成的分子,下列有关这两种粒子的说法不正确的是( )
| A. | 第二种粒子是氧元素的另一种核素 | |
| B. | “四中子”的质量数为4,其质量比氢原子大 | |
| C. | “四中子”不显电性 | |
| D. | 第二种粒子的化学式为O4,与O2互为同素异形体 |
18.药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得(已知在中学阶段羧基、酯基、酰胺基(-CONH-)不与氢气发生加成反应,给特殊信息除外,下同):
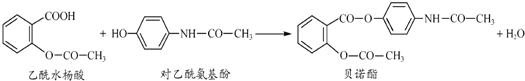
下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A. | 1mol贝诺酯分子可与6molH2完全反应 | |
| B. | 可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 | |
| D. | 乙酰水杨酸和对乙酰氨基酚均可与NaHCO3 溶液反应 |
5.将足量SO2气体通入下列各组溶液中,所含离子还能大量共存的是( )
| A. | Ba2+、Ca2+、Br-、Cl- | B. | CO32-、SO32-、K+、NH4+ | ||
| C. | Na+、NH4+、I-、HS- | D. | Na+、Ca2+、ClO-、NO3- |
2.常温下,下列溶液中微粒的物质的量的浓度关系正确的是( )
| A. | 0.1mol•L-1的CH3COOH溶液中:c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1mol•L的NaHCO3溶液中:c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 0.1mol•L的NH4Cl溶液中:c(NH4+)+c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 0.1mol•L的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
19.实验室进行:Cu+2H2SO4(浓)$\stackrel{△}{→}$CuSO4+SO2↑+2H2O,反应因硫酸浓度下降而停止.为测定反应残余液中硫酸的浓度,探究小组同学设计了4组实验方案(将残余液稀释至1L,每次均量取20mL稀释液进行实验),其中可行的是( )
| A. | 加入足量BaCl2溶液反应,过滤、洗涤、干燥、恒重,称得固体质量为W1 g | |
| B. | 加入过量的W2 g Zn充分反应后,过滤、洗涤、干燥、恒重,称得固体质量为W3 g | |
| C. | 加入过量的W4 g CaCO3反应停止后,过滤、洗涤、干燥、恒重,称得固体质量为W5 g | |
| D. | 滴入适当指示剂,用已知浓度的NaOH溶液进行滴定,消耗NaOH溶液的体积为V mL |
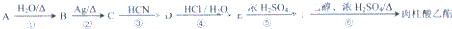
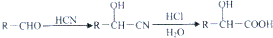
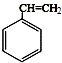 ,肉酸乙酯的结构简式
,肉酸乙酯的结构简式 .
. .
.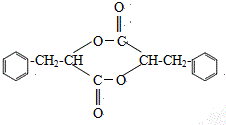 ;H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应.
;H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应.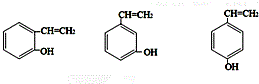 (填结构简式).
(填结构简式).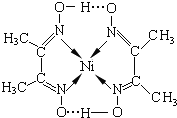 分子内含有的作用力有ACE(填序号).
分子内含有的作用力有ACE(填序号).