题目内容
6.下列叙述中错误的是( )| A. | 离子半径:S2->Cl->O2- | B. | 还原性:Na>Mg>Al | ||
| C. | 沸点:HF>HCl>HBr | D. | 酸性:HClO4>H2SO4>H3PO4 |
分析 A.电子层数越多,离子半径越大,电子层结构相同时,原子序数越大,半径越小;
B.同周期从左到右金属性依次减弱,还原性依次减弱;
C.氢化物的相对分子质量越大,沸点越高,含有氢键的沸点较高;
D.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强.
解答 解:A.电子层数越多,离子半径越大,电子层结构相同时,原子序数越大,半径越小,则离子半径:S2->Cl->O2-,故A正确;
B.同周期从左到右金属性依次减弱,还原性依次减弱,则还原性:Na>Mg>Al,故B正确;
C.氢化物的相对分子质量越大,沸点越高,含有氢键的沸点较高,相对分子质量:HCl<HBr,则沸点:HF>HBr>HCl,故C错误;
D.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,非金属性:Cl>S>P,则酸性:HClO4>H2SO4>H3PO4,故D正确.
故选C.
点评 本题考查元素周期律知识,侧重于学生的分析能力和基本概念的理解和运用的考查,注意元素的性质与对应单质、化合物的关系,把握元素周期律的递变规律是解答该类题目的关键,难度不大.

练习册系列答案
相关题目
16.下列分子或离子中,中心原子含有孤对电子的是( )
| A. | NH4+ | B. | CCl4 | C. | SiH4 | D. | H3P |
14.下列各项中表达正确的是( )
| A. | F的结构示意图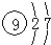 | B. | H2O的分子模型示意图 | ||
| C. | NaCl的电子式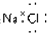 | D. | N2的结构式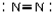 |
1.已知醇之间发生反应:R-OH+H-OR′$→_{△}^{浓硫酸}$R-O-R′(醚)+H2O,由两种不同的醇反应得到某醚M为C5H11OC5H11,它代表了多少种物质( )
| A. | 28 | B. | 36 | C. | 64 | D. | 48 |
11.下列实验一定能获得成功的是( )
| A. | 溴乙烷中加入足量NaOH溶液加热,然后冷却,再加入AgNO3溶液有浅黄色沉淀生成 | |
| B. | 蔗糖溶液中加入稀H2SO4微热,再加少量新制Cu(OH)2浊液煮沸,有红色沉淀生成 | |
| C. | 将红色铜丝在酒精灯上加热后,立即插入无水乙醇中,铜丝恢复成原来的红色 | |
| D. | 用分液漏斗直接分离乙醇和苯的混合液 |
13.下列各组离子在指定环境中一定能大量共存的是( )
| A. | 使pH试纸显深蓝色的溶液中,Cu2+、NO3-、Fe3+、SO42- | |
| B. | 在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+ | |
| C. | pH=0的溶液中:Al3+、NH4+、Ca2+、ClO- | |
| D. | 与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42- |
 ),所得HCNO的结构式是H-N=C=O,分子中氮原子杂化类型为sp2.
),所得HCNO的结构式是H-N=C=O,分子中氮原子杂化类型为sp2.
