题目内容
9.下列有关NaHSO3溶液的叙述正确的是( )| A. | 该溶液中,K+、Mg2+、Cl2、SO42-可以大量共存 | |
| B. | 已知电离平衡常数K(H2SO3)>K(H2CO3)>K(HSO3-),则该溶液中NH4+、HCO3-、Na+、Cl-不可以大量共存 | |
| C. | 和足量Ca(OH)2溶液反应的离子方程式:Ca2++OH-+HSO3-=CaSO3↓+H2O | |
| D. | 与稀HNO3反应的离子方程式:HSO3-+H+=SO2↑+H2O |
分析 A.氯气具有强氧化性,能够氧化亚硫酸氢钠;
B.K(H2CO3)>K(HSO3-),碳酸的酸性大于亚硫酸氢根离子,所以四种离子之间不反应,都不与亚硫酸氢根离子反应;
C.氢氧化钙足量,离子方程式按照亚硫酸氢钠的化学式组成书写;
D.稀硝酸具有强氧化性,能够氧化亚硫酸氢钠.
解答 解:A.Cl2能够氧化NaHSO3,在溶液中不能大量共存,故A错误;
B.由于K(H2CO3)>K(HSO3-),则酸性H2CO3>HSO3-,NH4+、HCO3-、Na+、Cl-之间不发生反应,都不与NaHSO3反应,在溶液中能够大量共存,故B正确;
C.亚硫酸氢钠和足量Ca(OH)2溶液反应生成亚硫酸钙和水,反应的离子方程式为:Ca2++OH-+HSO3-=CaSO3↓+H2O故C正确;
D.亚硫酸钠稀HNO3发生氧化还原反应生成硫酸钠和NO,不会生成二氧化硫气体,正确的离子方程式为:2NO3-+3HSO3-═3SO42-+H++2NO↑+H2O,故D错误;
故选BC.
点评 本题考查了离子共存、离子方程式的判断,题目难度中等,注意掌握离子反应发生条件,明确离子共存、离子方程式的判断方法,B为易错点,注意根据电离平衡常数正确判断书写大小.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.化合物HIn在水溶液中存在以下电离平衡:
HIn(溶液)?H+(溶液)+In-(溶液)
红色 黄色
故可用于作酸碱指示剂,现有浓度均为0.02mol/L的下列溶液
①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液⑤NaHCO3溶液 ⑥氨水
其中能使指示剂显红色的是( )
HIn(溶液)?H+(溶液)+In-(溶液)
红色 黄色
故可用于作酸碱指示剂,现有浓度均为0.02mol/L的下列溶液
①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液⑤NaHCO3溶液 ⑥氨水
其中能使指示剂显红色的是( )
| A. | ①④ | B. | ①④⑤ | C. | ②⑥ | D. | ②⑤⑥ |
4.下列保存物质的方法正确的是( )
| A. | 液氯贮存在干燥的钢瓶里 | |
| B. | 少量的锂、钠、钾均保存在煤油中 | |
| C. | 浓溴水保存在带橡皮塞的棕色细口瓶中 | |
| D. | 用排水法收集满一瓶氢气,用玻璃片盖住瓶口,瓶口朝上放置 |
14.下列各项中表达正确的是( )
| A. | F的结构示意图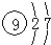 | B. | H2O的分子模型示意图 | ||
| C. | NaCl的电子式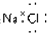 | D. | N2的结构式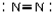 |
1.已知醇之间发生反应:R-OH+H-OR′$→_{△}^{浓硫酸}$R-O-R′(醚)+H2O,由两种不同的醇反应得到某醚M为C5H11OC5H11,它代表了多少种物质( )
| A. | 28 | B. | 36 | C. | 64 | D. | 48 |
19.下列反应中前者属于取代反应,后者属于加成反应的是( )
| A. | 光照甲烷与氯气的混合物;乙烯使酸性高锰酸 钾溶液褪色 | |
| B. | 乙烯使溴的四氯化碳溶液褪色;苯与氢气在一定条件下反应生成环己烷 | |
| C. | 苯滴人浓硝酸和浓硫酸的混合液中水浴加热; 乙烯与水蒸气在一定条件下反应生成乙醇 | |
| D. | 在苯中滴人溴水,溴水褪色;乙烯使溴水褪色. |
 在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验“.请回答该实验中的问题.
在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验“.请回答该实验中的问题. ),所得HCNO的结构式是H-N=C=O,分子中氮原子杂化类型为sp2.
),所得HCNO的结构式是H-N=C=O,分子中氮原子杂化类型为sp2.