题目内容
【题目】为了配制NH4+浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入:①适量HCl②适量NaCl③适量的氨水④适量的NaOH,正确的是
A. ①② B. ④ C. ③④ D. ③
【答案】D
【解析】氯化铵是弱碱强酸盐,由于![]() 水解,导致溶液中
水解,导致溶液中![]() ,溶液呈酸性,为了配制
,溶液呈酸性,为了配制![]() 与
与![]() 的浓度比为1:1的溶液,可以增加铵根离子浓度,或减少溶液中氯离子的浓度;①加入
的浓度比为1:1的溶液,可以增加铵根离子浓度,或减少溶液中氯离子的浓度;①加入![]() 后氯离子浓度增加,不能配制
后氯离子浓度增加,不能配制![]() 与
与![]() 的浓度比为1:1的溶液,①错误;②加入
的浓度比为1:1的溶液,①错误;②加入![]() 后氯离子浓度增加,不能配制
后氯离子浓度增加,不能配制![]() 与
与![]() 的浓度比为1:1的溶液,②错误;③加入适当氨水增加了铵根离子浓度,可以配制
的浓度比为1:1的溶液,②错误;③加入适当氨水增加了铵根离子浓度,可以配制![]() 与
与![]() 的浓度比为1:1的溶液,③正确;④加入
的浓度比为1:1的溶液,③正确;④加入![]() 后,中和了氢离子,平衡右移,铵根离子浓度降低,不能配制
后,中和了氢离子,平衡右移,铵根离子浓度降低,不能配制![]() 与
与![]() 的浓度比为1:1的溶液,④错误;只有③符合题意,正确选项D。
的浓度比为1:1的溶液,④错误;只有③符合题意,正确选项D。

 习题精选系列答案
习题精选系列答案【题目】(1)根据氧化还原反应2H2+O2===2H2O,设计成燃料电池,负极通的气体应是___________。
(2)如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是_____。

A.a电极是负极
B.b电极的电极反应为4OH--4e-====2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(3)根据氢氧燃料电池电解质溶液的不同,填写下表:
电解质溶液 | H2SO4溶液 | KOH溶液 |
负极反应 | ______________ | |
正极反应 | ___________ | |
溶液的pH变化 | _____________ |
(4)若把H2改为CH4,KOH溶液作电解质溶液,则负极反应为_________________________________________。
【题目】单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
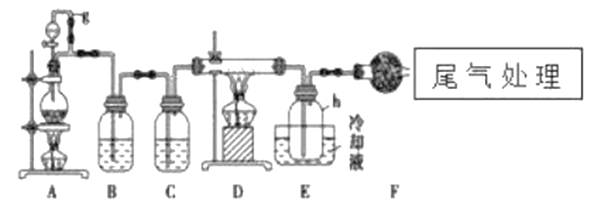
相关信息如下:
a.四氯化硅接触水会发生化学反应;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | BC13 | A1C13 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | - | 315 | - |
熔点/℃ | -70.0 | -107.2 | - | - | - |
升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:___________,D中发生反应的化学方程式___________。
(2)A中g管的作用是__________________,装置C中的试剂是___________,作用是___________。
(3)装置E中的h瓶需要冷却的理由是______________________。
(4)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是___________(填写元素符号)。
(5)过量的氯气可以用石灰乳来处理,请写出该反应的化学方程式_____________________。