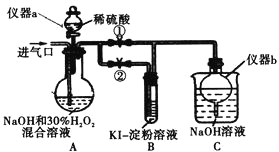
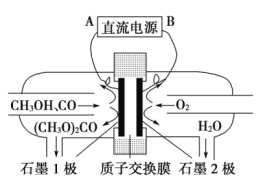
题目内容
【题目】常温下有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和Na2SO4溶液中的一种。已知A、B溶液中水的电离程度相同,A、C溶液的pH相同。下列说法中不正确的是
A.D溶液的pH=7
B.四种溶液相比,C溶液中水的电离程度最小
C.A与C等体积混合后,溶液中有c(Cl)>c(H+)>c(NH4+)>c(OH)
D.B与D等体积混合后,溶液中有c(OH)=c(CH3COOH)+c(H+)
【答案】C
【解析】
CH3COONa、NH4Cl在溶液中都发生水解,从而促进水电离,盐酸直接电离出H+,抑制水电离,Na2SO4对水的电离不产生影响;NH4Cl溶液、盐酸都显酸性,CH3COONa溶液显碱性,Na2SO4溶液显中性。由“A、B溶液中水的电离程度相同,A、C溶液的pH相同”,可确定A为NH4Cl溶液,B为CH3COONa,C为盐酸,D为Na2SO4溶液。
A. 常温下,D溶液(Na2SO4溶液)中,Na2SO4对水的电离不产生影响,所以其pH=7,A正确;
B. CH3COONa、NH4Cl促进水电离,盐酸抑制水电离,Na2SO4对水的电离不产生影响,所以C溶液(盐酸)中水的电离程度最小,B正确;
C. 因为NH4Cl与HCl的pH相同,所以c(NH4Cl)>c(HCl),二者等体积混合后,虽然NH4+发生水解,但离子浓度减小很少,所以溶液中有c(Cl)>c(NH4+)>c(H+)>c(OH),C错误;
D. CH3COONa与Na2SO4等体积混合后,溶液中存在CH3COO-+H2O![]() CH3COOH
CH3COOH
+OH-、H2O![]() H++OH- ,所以c(OH)=c(CH3COOH)+c(H+),D正确。
H++OH- ,所以c(OH)=c(CH3COOH)+c(H+),D正确。
故选C。

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目