题目内容
氢氟酸(HF)是一种弱酸。25℃时,向20mL0.1mol/L氢氟酸中加入VmL 0.1mol/LNaOH溶液充分反应。已知:
HF(aq)+OH-(aq)=F-(aq)+H2O(l) △H=-67.7kJ/mol
H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol
根据题意,下列判断或结论正确的是
| A.氢氟酸的电离过程是吸热的 |
| B.当V=20时,溶液中:c(F-)<c(Na+)=0.1mol/L |
| C.当V<20时,溶液中离子浓度关系可能为:c(Na+)=c(F-) |
| D.当V>20时,溶液中离子浓度关系一定为:c(Na+)>c(F-)>c(OH-)>c(H+) |
C
解析试题分析:A、已知①HF(aq)+OH-(aq)=F-(aq)+H2O(l) △H=-67.7kJ/mol。②H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,则依据盖斯定律可知①-②即得到HF(aq) F-(aq)+H+(aq),所以△H=-67.7kJ/mol+57.3kJ/mol=-10.0kJ/mol,因此氢氟酸的电离过程是放热的,A不正确;B、当V=20时,二者恰好中和生成氟化钠,F-水解溶液显碱性,所以溶液中:c(F-)<c(Na+)=
F-(aq)+H+(aq),所以△H=-67.7kJ/mol+57.3kJ/mol=-10.0kJ/mol,因此氢氟酸的电离过程是放热的,A不正确;B、当V=20时,二者恰好中和生成氟化钠,F-水解溶液显碱性,所以溶液中:c(F-)<c(Na+)= ×0.1mol/L=0.05mol/L,B不正确;C、当V<20时,氢氟酸过量,因此所得溶液可能显中性。则根据电荷守恒可知c(Na+)+ c(H+)=c(F-)+c(OH-),所以溶液中离子浓度关系可能为:c(Na+)=c(F-),C正确;D、当V>20时,氢氧化钠过量,溶液显碱性,则溶液中离子浓度关系可能为:c(Na+)>c(OH-)>c(F-)>c(H+),D不正确,答案选C。
×0.1mol/L=0.05mol/L,B不正确;C、当V<20时,氢氟酸过量,因此所得溶液可能显中性。则根据电荷守恒可知c(Na+)+ c(H+)=c(F-)+c(OH-),所以溶液中离子浓度关系可能为:c(Na+)=c(F-),C正确;D、当V>20时,氢氧化钠过量,溶液显碱性,则溶液中离子浓度关系可能为:c(Na+)>c(OH-)>c(F-)>c(H+),D不正确,答案选C。
考点:考查盖斯定律的应用、溶液中离子浓度大小比较

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案节能减排成为社会发展过程中不可回避的问题。下列说法正确的是
①推广乙醇汽油可以减轻环境污染,降低尾气中一氧化碳含量。
②乙醇汽油作为一种新型清洁燃料,是目前世界上可再生能源的发展重点之一。
③乙醇属于可再生资源,使用乙醇汽油可以缓解目前石油紧缺的矛盾。
④太阳能、风能、水能、生物质能、地热能和海洋能等都属于可再生能源。
⑤乙醇属于一级能源
| A.①②⑤ | B.①②③ | C.③④ | D.①②③④ |
未来新能源的特点是资源丰富,使用时污染很小,可再生。下列符合未来新能源标准的是:①天然气 ②煤 ③石油 ④太阳能 ⑤生物质能 ⑥风能 ⑦氢能
| A.①②③④ | B.④⑤⑥⑦ | C.③⑤⑥⑦ | D.③④⑤⑥⑦ |
氢化热是指一定条件下,1 mol 不饱和化合物加氢时放出的热量。表中是环己烯( )、环己二烯(
)、环己二烯( )和苯的氢化热数据。
)和苯的氢化热数据。
| 化合物 | 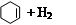  | 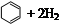  | 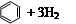  |
| 氢化热 (kJ/mol) | 119.7 | 232.7 | 208.4 |
根据表中数据推断正确的是
A.环己二烯与H2的反应最剧烈
B.环己烯、环己二烯和苯有相同的官能团
C.三种化合物中环己二烯的稳定性最强
D.上述条件下,1 mol
 转变为
转变为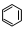 时放热
时放热 温家宝总理在2010年政府工作报告中提出,推广高效节能技术,提倡低碳生活,积极发展新能源和可再生能源。下列有关做法与此不相符的是( )
| A.大力开发丰富的煤炭资源,减少对石油的依赖 |
| B.在西部和沿海地区兴建风力发电站,解决能源问题 |
| C.世博会很多场馆的外壳使用非晶硅薄膜,以充分利用太阳能,体现低碳经济 |
| D.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 |
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是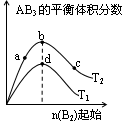
A.若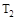 > >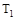 ,则正反应一定是放热反应 ,则正反应一定是放热反应 |
B.达到平衡时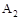 的转化率大小为:b>a>c 的转化率大小为:b>a>c |
C.若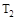 > >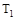 ,达到平衡时b、d点的反应速率为 ,达到平衡时b、d点的反应速率为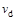 > >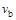 |
D.在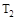 和 和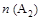 不变时达到平衡, 不变时达到平衡,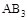 的物质的量大小为:c>b>a 的物质的量大小为:c>b>a |
下列有关热化学方程式的叙述,正确的是
| A.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
B.由N2O 4(g)  2NO2(g)△H=" -56.9" kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ 2NO2(g)△H=" -56.9" kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ |
| C.由:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量为57.3 kJ |
| D.已知101kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221kJ/mol,则1 mol碳完全燃烧放出的热量大于110.5kJ |
25℃、101kPa下,2g氢气燃烧生成液态水,放出285.8 kJ热量,表示该反应的热化学方程式正确的是
| A.2H2(g)+O2(g)=2H2O(l)△H=-285.8 kJ/mol |
| B.2H2(g)+O2(g)=2H2O(l)△H=+571.6 kJ/mol |
| C.2H2(g)+O2(g)=2H2O(g)△H=-571.6kJ/mol |
D.H2(g)+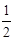 O2(g)=H2O(l)△H=-285.8 kJ/mol O2(g)=H2O(l)△H=-285.8 kJ/mol |
反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是(双选) ( )。
C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是(双选) ( )。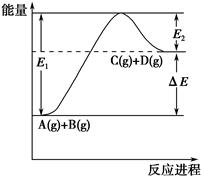
| A.该反应是放热反应 |
| B.加入催化剂后,反应加快,ΔE减小 |
| C.反应物的总键能大于生成物的总键能 |
| D.反应达到平衡时,升高温度,A的转化率增大 |