��Ŀ����
�⻯����ָһ�������£�1 mol �����ͻ��������ʱ�ų��������������ǻ���ϩ�� ����������ϩ��
����������ϩ�� ���ͱ����⻯�����ݡ�
���ͱ����⻯�����ݡ�
| ������ | 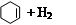  | 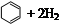  | 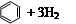  |
| �⻯�� (kJ/mol) | 119.7 | 232.7 | 208.4 |
���ݱ��������ƶ���ȷ����
A��������ϩ��H2�ķ�Ӧ�����
B������ϩ��������ϩ�ͱ�����ͬ�Ĺ�����
C�����ֻ������л�����ϩ���ȶ�����ǿ
D�����������£�1 mol
 ת��Ϊ
ת��Ϊ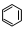 ʱ����
ʱ����
D
�������������A��ͨ���⻯��ֻ���жϷ�Ӧ�ȵı仯������ж��䷴Ӧ���ҳ̶ȣ�����B������ϩ��������ϩ����̼̼˫����������û�У���û����ͬ�Ĺ����ţ�����C����������Խ������Խ�ȶ����������ȶ��ģ�����D��ȷ��
���㣺������Ҫ��������⻯�ȿ��鷴Ӧ�Ⱥ����ʵ��ȶ��ԡ�

 ������ѧ���̲���ȫ���ϵ�д�
������ѧ���̲���ȫ���ϵ�д� ������ʱ����ҵ����ϵ�д�
������ʱ����ҵ����ϵ�д� ��ĩ���ƾ�ϵ�д�
��ĩ���ƾ�ϵ�д����и�ͼ�й����ı仯�����д������
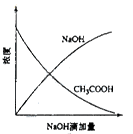
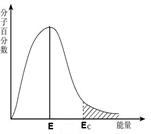
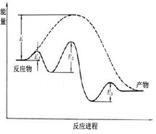
A B C D
| A��ͼAΪ�������еμ�NaOH�����кͷ�Ӧ��������Һ�¶ȵı仯���� |
| B��ͼBΪ������еμ�NaOH�����кͷ�Ӧ�����и�����Ũ�ȵı仯���� |
| C��ͼC��������Ec�ķ��ӳ�Ϊ����ӣ�EΪ����ƽ������������ΪEc��E |
| D��ͼDΪδ��������ͼ�������ķ�Ӧ�����е������仯 |
��20.0 g NaOH��ϡ��Һ��ϡ������ȫ��Ӧʱ���ų�28.7 kJ����������ʾ�÷�Ӧ���Ȼ�ѧ����ʽ��ȷ����
A��NaOH(aq)+HCl(aq)��NaCl(aq)+H20(l)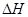 =" +28.7" kJ��mol-1 =" +28.7" kJ��mol-1 |
B��NaOH(aq)+HCl(aq)��NaCl(aq)+H20(l)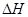 =" -28.7" kJ��mol-1 =" -28.7" kJ��mol-1 |
C��NaOH(aq)+HCl(aq)��NaCl(aq)+H20(l)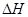 =" +57.4" kJ��mol-1 =" +57.4" kJ��mol-1 |
D��NaOH(aq)+HCl(aq)��NaCl(aq)+H20(l)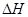 =" -57.4" kJ��mol-1 =" -57.4" kJ��mol-1 |
�����й��Ȼ�ѧ����ʽ�������У���ȷ����
| A����20.0g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28.7kJ�����������ʾ�÷�Ӧ�к��ȵ��Ȼ�ѧ����ʽΪNaOH(aq)+HCl(aq)=NaC1(aq)+H2O(1) ��H=+57.4kJ/mo1 |
| B����֪C(ʯī��s)=C(���ʯ��s) ��H>0����ʯī�Ƚ��ʯ�ȶ� |
| C����֪2H2(g)+O2(g)=2H2O(g) ��H =��483.6kJ/mol����H2ȼ����Ϊ241.8kJ/mol |
| D����֪2C(s)+2O2(g)=2CO2(g) ��H 1��2C(s)+O2(g)="2CO(g)" ��H 2����H 1<��H 2 |
����ᣨHF����һ�����ᡣ25��ʱ����20mL0.1mol/L������м���VmL 0.1mol/LNaOH��Һ��ַ�Ӧ����֪��
HF��aq����OH����aq����F����aq����H2O��l�� ��H����67.7kJ/mol
H����aq����OH����aq����H2O��l�� ��H����57.3kJ/mol
�������⣬�����жϻ������ȷ����
| A�������ĵ�����������ȵ� |
| B����V��20ʱ����Һ�У�c��F������c��Na������0.1mol/L |
| C����V��20ʱ����Һ������Ũ�ȹ�ϵ����Ϊ��c��Na������c��F���� |
| D����V��20ʱ����Һ������Ũ�ȹ�ϵһ��Ϊ��c��Na������c��F������c��OH������c��H���� |
X��Y��Z��R��W��5�ֶ�����Ԫ�أ�ԭ�����������������ǿ�������ӻ�����Z2Y���ۻ�����RY3��XW4����֪Y��Rͬ���壬Z��R��Wͬ���ڡ�����˵������ȷ���ǣ� ��
| A��ԭ�Ӱ뾶��Z��R��W |
| B��X2W6�����и�ԭ�Ӿ�����8���ӽṹ |
| C����̬�⻯����ȶ��ԣ�HmW��HnR |
| D��Y��Z�γɵĻ�������ֻ���ܴ������Ӽ� |
���칬һ�š�Ŀ��������롰���۾źš����˷ɴ��Ľ���Խӣ���־���ҹ��߱��˽���ռ�վ�Ļ��������������й�˵����ȷ����
| A��������յĶ�����Ҫ��Դ�ڻ�ѧ�� |
| B�������۾źš��ɴ���̫���ܷ��彫̫����ֱ��ת��Ϊ���� |
| C�����칬һ�š��е�����ȼ�ϵ�ؽ�����ת��Ϊ��ѧ�� |
| D�����칬һ�š�����̫���ܽ�ˮ���ȷֽ�Ϊ���������� |
�����йط�Ӧ�ȵ�˵����ȷ����( )
| A���κ�ǿ����ǿ�Ӧ����1 mol H2O�Ĺ����У��ų�����������ͬ |
| B���������������������ֱ���ȫȼ�գ����߷ų������� |
| C�������κ�һ�����ȷ�Ӧ��ʹ�ô�����H������ |
| D����֪��O=O������Ϊa kJ/ mol��H��H������Ϊb kJ/ mol��ˮ������H��O����Ϊc kJ/ mol����֪��H2O(g)= H2O(l)��H=" -d" kJ/ mol����Ӧ2H2 (g) + O2(g) = 2H2O(l) �Ħ�HΪ����a+2b-4c-2d��kJ/ mol |
25 �桢101 kPa�£�̼������������������ǵ�ȼ���������Ǧ�H����393.5 kJ��mol��1����H����285.8 kJ��mol��1����H����890.3 kJmol��1����H����2 800 kJ��mol��1���������Ȼ�ѧ����ʽ��ȷ���� (����)��
A��C(s)��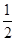 O2(g)===CO(g)����H����393.5 kJ��mol��1 O2(g)===CO(g)����H����393.5 kJ��mol��1 |
| B��2H2(g)��O2(g)===2H2O(l)����H����571.6 kJ��mol��1 |
| C��CH4(g)��2O2(g)===CO2(g)��2H2O(g)��H����890.3 kJ��mol��1 |
D��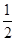 C6H12O6(s)��3O2(g)===3CO2(g)��3H2O(g)��H����1 400 kJ��mol��1 C6H12O6(s)��3O2(g)===3CO2(g)��3H2O(g)��H����1 400 kJ��mol��1 |