题目内容
节能减排成为社会发展过程中不可回避的问题。下列说法正确的是
①推广乙醇汽油可以减轻环境污染,降低尾气中一氧化碳含量。
②乙醇汽油作为一种新型清洁燃料,是目前世界上可再生能源的发展重点之一。
③乙醇属于可再生资源,使用乙醇汽油可以缓解目前石油紧缺的矛盾。
④太阳能、风能、水能、生物质能、地热能和海洋能等都属于可再生能源。
⑤乙醇属于一级能源
| A.①②⑤ | B.①②③ | C.③④ | D.①②③④ |
D
解析试题分析:①推广乙醇汽油可以减轻环境污染,降低尾气中一氧化碳含量,有利于改善大气环境,正确;②乙醇汽油作为一种新型清洁燃料,是目前世界上可再生能源的发展重点之一,正确;③乙醇属于可再生资源,使用乙醇汽油可以缓解目前石油紧缺的矛盾,减少了化石燃料的使用,正确;④太阳能、风能、水能、生物质能、地热能和海洋能都属于可再生能源,正确;⑤乙醇属于二级能源,错误;综上所述:①②③④正确,选D。
考点:考查了新型燃料的开发和利用。

已知下列热化学方程式:Zn(s) + 1/2 O2(g)= ZnO(s) △H1;Hg(l) + 1/2 O2(g)=HgO(s) △H2;
则 Zn(s)+ HgO(s)=Hg(l)+ ZnO(s),△H值为
| A.△H2-△H1 | B.△H2+△H1 | C.△H1-△H2 | D.-△H1-△H2 |
下列表述不正确的是
| A.对于一个确定的反应来说,平衡常数的数值越大,反应限度越大 |
| B.铝热反应会放出大量的热,因此常温下就能顺利发生 |
| C.碳酸铵[(NH4)2CO3]在室温下就能自发地分解产生氨气,碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大 |
D.对于化学反应COCl2(g) CO(g)+Cl2(g) ΔH<0当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率 CO(g)+Cl2(g) ΔH<0当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率 |
下列各图有关量的变化趋势中错误的是
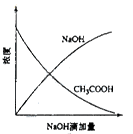
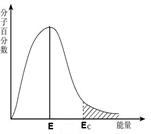
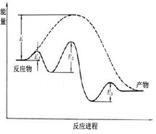
A B C D
| A.图A为向盐酸中滴加NaOH发生中和反应过程中溶液温度的变化趋势 |
| B.图B为向醋酸中滴加NaOH发生中和反应过程中各物质浓度的变化趋势 |
| C.图C中能量≥Ec的分子称为活化分子,E为分子平均能量,则活化能为Ec-E |
| D.图D为未加入催化剂和加入催化剂的反应进程中的能量变化 |
下列说法错误的是
| A.由单质A转化为单质B,ΔH=+119kJ/mol,可知单质A比单质B稳定 |
| B.灼热的碳与CO2反应既是氧化还原反应,又是生成物总能量高于反应物总能量的反应 |
| C.决定化学反应速率的根本因素是参加反应的各物质的结构和性质 |
| D.对于一个可逆反应(ΔH<0)达到平衡后,升高温度可以增加活化分子的百分数,提高有效碰撞的次数,使V正增大的倍数大于V逆增大的倍数,从而使化学反应平衡逆向移动 |
含20.0 g NaOH的稀溶液与稀盐酸完全反应时,放出28.7 kJ的热量,表示该反应的热化学方程式正确的是
A.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l)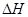 =" +28.7" kJ·mol-1 =" +28.7" kJ·mol-1 |
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l)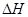 =" -28.7" kJ·mol-1 =" -28.7" kJ·mol-1 |
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l)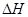 =" +57.4" kJ·mol-1 =" +57.4" kJ·mol-1 |
D.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l)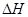 =" -57.4" kJ·mol-1 =" -57.4" kJ·mol-1 |
氢氟酸(HF)是一种弱酸。25℃时,向20mL0.1mol/L氢氟酸中加入VmL 0.1mol/LNaOH溶液充分反应。已知:
HF(aq)+OH-(aq)=F-(aq)+H2O(l) △H=-67.7kJ/mol
H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol
根据题意,下列判断或结论正确的是
| A.氢氟酸的电离过程是吸热的 |
| B.当V=20时,溶液中:c(F-)<c(Na+)=0.1mol/L |
| C.当V<20时,溶液中离子浓度关系可能为:c(Na+)=c(F-) |
| D.当V>20时,溶液中离子浓度关系一定为:c(Na+)>c(F-)>c(OH-)>c(H+) |
关于下图,下列说法不正确的是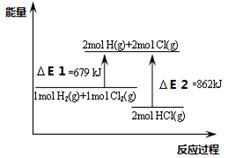
| A.△E2是2mol HCl(g)的总键能 |
| B.该反应的热化学方程式为:H2(g)+Cl2(g)=2HCl(g)△H =-183KJ.mol-1 |
| C.通常情况下H2与Cl2混和不会反应 |
| D.该反应是一个吸热反应 |
现有两个热化学反应方程式: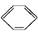 (l)+H2(g)
(l)+H2(g)
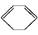 (l) ΔH>0①
(l) ΔH>0① 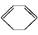 (l)+2H2(g)
(l)+2H2(g)
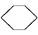 (l) ΔH<0②
(l) ΔH<0②
下列说法中不正确的是( )
| A.①②都属于加成反应 |
| B.在通常条件下,①②都能自发进行 |
| C.①吸热、②放热的事实说明苯环中含有的并不是碳碳双键 |
| D.①②中的所有有机物均可使溴水褪色,但褪色原理不完全相同 |