��Ŀ����
ij��ѧС���о���������������ʱ���ı��ܱ�������ijһ������A2(g)+3B2(g) 2AB3(g)��ѧƽ��״̬��Ӱ�죬�õ�����ͼ��ʾ�����ߣ�ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ����������ж���ȷ����
2AB3(g)��ѧƽ��״̬��Ӱ�죬�õ�����ͼ��ʾ�����ߣ�ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ����������ж���ȷ����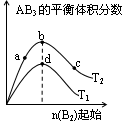
A���� �� �� ��������Ӧһ���Ƿ��ȷ�Ӧ ��������Ӧһ���Ƿ��ȷ�Ӧ |
B���ﵽƽ��ʱ ��ת���ʴ�СΪ��b��a��c ��ת���ʴ�СΪ��b��a��c |
C����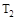 �� ��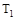 ���ﵽƽ��ʱb��d��ķ�Ӧ����Ϊ ���ﵽƽ��ʱb��d��ķ�Ӧ����Ϊ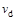 �� ��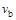 |
D����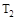 �� ��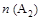 ����ʱ�ﵽƽ�⣬ ����ʱ�ﵽƽ�⣬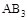 �����ʵ�����СΪ��c��b��a �����ʵ�����СΪ��c��b��a |
D
�������������A����T2��T1����ͼ���֪�¶���������������ʵ�������˵�������¶�ƽ��������Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ����A����B������ͼ���֪��a��b��c������B����ʼ���ʵ������������ڿ��淴Ӧ��˵������һ�ַ�Ӧ������ʵ�����Ũ�ȣ�������ƽ��������Ӧ�����ƶ�������һ�ַ�Ӧ���ת����������ﵽƽ��ʱA2��ת���ʴ�СΪ��a��b��c����B����C���¶�Խ������Խ�죬�¶�T2��T1���ﵽƽ��ʱb��d��ķ�Ӧ����Ϊvd��vb����C�����ڿ��淴Ӧ��˵������һ�ַ�Ӧ������ʵ�����Ũ�ȣ�������ƽ��������Ӧ�����ƶ�������������ʵ������࣬���Դﵽƽ��ʱ��AB3�����ʵ�����СΪc��b��a����D��ȷ��
���㣺��ѧƽ�⽨���Ĺ���

 ���������������Բ��������ϵ�д�
���������������Բ��������ϵ�д���20.0 g NaOH��ϡ��Һ��ϡ������ȫ��Ӧʱ���ų�28.7 kJ����������ʾ�÷�Ӧ���Ȼ�ѧ����ʽ��ȷ����
A��NaOH(aq)+HCl(aq)��NaCl(aq)+H20(l)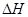 =" +28.7" kJ��mol-1 =" +28.7" kJ��mol-1 |
B��NaOH(aq)+HCl(aq)��NaCl(aq)+H20(l)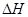 =" -28.7" kJ��mol-1 =" -28.7" kJ��mol-1 |
C��NaOH(aq)+HCl(aq)��NaCl(aq)+H20(l)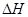 =" +57.4" kJ��mol-1 =" +57.4" kJ��mol-1 |
D��NaOH(aq)+HCl(aq)��NaCl(aq)+H20(l)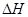 =" -57.4" kJ��mol-1 =" -57.4" kJ��mol-1 |
����ᣨHF����һ�����ᡣ25��ʱ����20mL0.1mol/L������м���VmL 0.1mol/LNaOH��Һ��ַ�Ӧ����֪��
HF��aq����OH����aq����F����aq����H2O��l�� ��H����67.7kJ/mol
H����aq����OH����aq����H2O��l�� ��H����57.3kJ/mol
�������⣬�����жϻ������ȷ����
| A�������ĵ�����������ȵ� |
| B����V��20ʱ����Һ�У�c��F������c��Na������0.1mol/L |
| C����V��20ʱ����Һ������Ũ�ȹ�ϵ����Ϊ��c��Na������c��F���� |
| D����V��20ʱ����Һ������Ũ�ȹ�ϵһ��Ϊ��c��Na������c��F������c��OH������c��H���� |
X��Y��Z��R��W��5�ֶ�����Ԫ�أ�ԭ�����������������ǿ�������ӻ�����Z2Y���ۻ�����RY3��XW4����֪Y��Rͬ���壬Z��R��Wͬ���ڡ�����˵������ȷ���ǣ� ��
| A��ԭ�Ӱ뾶��Z��R��W |
| B��X2W6�����и�ԭ�Ӿ�����8���ӽṹ |
| C����̬�⻯����ȶ��ԣ�HmW��HnR |
| D��Y��Z�γɵĻ�������ֻ���ܴ������Ӽ� |
��ͬ��ͬѹ��,���и����Ȼ�ѧ����ʽ�У���H2>��H1����
| A��S(g)+O2(g)��SO2(g)����H1�� S(s)+O2(g)��SO2(g)����H2 |
| B��2H2(g)+O2(g)��2H2O(g)����H1�� 2H2(g)+O2(g)��2H2O(l)����H2 |
C��C(s)+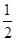 O2(g)=CO(g)��H1��C(s)+O2(g)=CO2(g) ��H2 O2(g)=CO(g)��H1��C(s)+O2(g)=CO2(g) ��H2 |
| D��H2(g)+Cl2(g)��2HCl(g)����H1�� 2H2(g)+2Cl2(g)��4HCl(g)����H2 |
���칬һ�š�Ŀ��������롰���۾źš����˷ɴ��Ľ���Խӣ���־���ҹ��߱��˽���ռ�վ�Ļ��������������й�˵����ȷ����
| A��������յĶ�����Ҫ��Դ�ڻ�ѧ�� |
| B�������۾źš��ɴ���̫���ܷ��彫̫����ֱ��ת��Ϊ���� |
| C�����칬һ�š��е�����ȼ�ϵ�ؽ�����ת��Ϊ��ѧ�� |
| D�����칬һ�š�����̫���ܽ�ˮ���ȷֽ�Ϊ���������� |
������ͼ������˵������ȷ����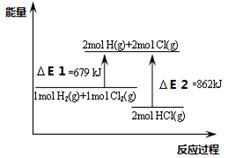
| A����E2��2mol HCl(g)���ܼ��� |
| B���÷�Ӧ���Ȼ�ѧ����ʽΪ��H2(g)+Cl2(g)��2HCl(g)��H ����183KJ.mol-1 |
| C��ͨ�������H2��Cl2��Ͳ��ᷴӦ |
| D���÷�Ӧ��һ�����ȷ�Ӧ |
�����Ȼ�ѧ����ʽ�У���ȷ����
| A�������ȼ����Ϊ890.3 kJ��mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4��g��+2O2��g��=CO2��g��+2H2O(g)��H=-890��3 kJ��mol-1 |
B����N2��g��+3H2��g�� 2NH3��g����H=-92��4 kJ��mol-1�Ȼ�ѧ����ʽ��֪�� ����Ӧ��ת��6NA����ʱ����Ӧ�ų�����С��92.4 kJ 2NH3��g����H=-92��4 kJ��mol-1�Ȼ�ѧ����ʽ��֪�� ����Ӧ��ת��6NA����ʱ����Ӧ�ų�����С��92.4 kJ |
| C��HCl��NaOH��Ӧ���к��ȡ�H="-57.3" kJ��mol-1����H2SO4��Ca��OH��2��Ӧ���к��ȡ�H=2����-57��3��kJ��mol-1 |
| D����101 kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285��8kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ2H2(g)+O2(g)=2H2O(1)��H=-571��6 kJ��mol-1 |
���������Ȼ�ѧ��Ӧ����ʽ: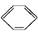 (l)+H2(g)
(l)+H2(g)
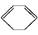 (l)����H>0��
(l)����H>0�� 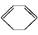 (l)+2H2(g)
(l)+2H2(g)
 (l)����H<0��
(l)����H<0��
����˵���в���ȷ����(����)
| A���٢ڶ����ڼӳɷ�Ӧ |
| B����ͨ��������,�٢ڶ����Է����� |
| C�������ȡ��ڷ��ȵ���ʵ˵�������к��еIJ�����̼̼˫�� |
| D���٢��е������л������ʹ��ˮ��ɫ,����ɫԭ������ȫ��ͬ |