题目内容
【题目】在100℃时,将0.100mol的N2O4气体充入1L抽空密闭容器中,发生反应:N2O4(g)2NO2.现在隔一定时间对该容器内的物质进行分析,得到如下表格:
t/s c/(molL﹣1) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/(molL﹣1) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2)/(molL﹣1) | 0 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试回答下列问题:
(1)达到平衡时N2O4的转化率为_____%,表中c2_____c3,a_____b(后两空选填>、<、=)
(2)20 s的N2O4的浓度c1=_____mol/L在0~20s内N2O4的平均反应速率为_____mol/(Ls);
(3)若其他反应条件以及初始物质物质的量不变,将反应的温度降低到80℃时,达到平衡时NO2的物质的量为0.100 mol,那么正反应是_____反应(选填吸热或放热)
(4)若在相同初始情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度为_____mol/L。
【答案】60 > = 0.07mol/L 0.0015 吸热 0.20mol/L
【解析】
(1)由表可知,60s时反应达平衡,根据方程式计算△c(N2O4),根据转化率计算平衡时N2O4的转化率;根据方程式计算,计算c2、c3,据此解答;60s后反应达平衡,反应混合物各组分的浓度不变;
(2)由△c(NO2),根据方程式计算△c(N2O4),20s的四氧化二氮的浓度=起始浓度-△c(N2O4);
根据v=![]() 计算v(N2O4);
计算v(N2O4);
(3)80℃时,达到平衡时NO2的物质的量为0.100mol,说明降低温度后平衡向着逆向移动,据此判断反应热;
(4)达到上述同样的平衡状态,说明两个平衡为等效平衡,按化学计量数换算到N2O4一边,满足c(N2O4)为0.100mol/L。
(1)由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,根据反应N2O42NO2可知,平衡时消耗二氧化氮的浓度为:c(N2O4)=0.120mol/L×![]() =0.06mol/L,则平衡时N2O4的转化率为:
=0.06mol/L,则平衡时N2O4的转化率为:![]() =60%;达到平衡时各组分的浓度不再变化,则c3=a=b=0.1mol/L﹣0.06mol/L=0.04mol/L;由表可知,40s时,c(N2O4)=0.050mol/L,N2O4的浓度变化为:(0.1﹣0.05)mol/L=0.05mol/L,则c2=0.05mol/L×2=0.10mol/L,所以c2>c3,故答案为:60;>;=;
=60%;达到平衡时各组分的浓度不再变化,则c3=a=b=0.1mol/L﹣0.06mol/L=0.04mol/L;由表可知,40s时,c(N2O4)=0.050mol/L,N2O4的浓度变化为:(0.1﹣0.05)mol/L=0.05mol/L,则c2=0.05mol/L×2=0.10mol/L,所以c2>c3,故答案为:60;>;=;
(2)由表可知,20s时,c(NO2)=0.060mol/L,则反应消耗 N2O4的浓度0.030mol/L,则20s的四氧化二氮的浓度c1=0.1mol/L﹣0.03mol/L=0.07mol/L;在0s~20s内四氧化二氮的平均反应速率为v(N2O4)=![]() =0.0015mol(Ls)﹣1,
=0.0015mol(Ls)﹣1,
故答案为:0.07mol/L;0.0015;
(3)若其他反应条件以及初始物质物质的量不变,将反应的温度降低到80℃时,达到平衡时NO2的物质的量为0.100 mol<0.120 mol/L,说明降低温度后平衡向着放热的逆向移动,则逆向为放热反应,故正反应为吸热反应,故答案为:吸热;
(4)达到上述同样的平衡状态,为等效平衡,按化学计量数换算到N2O4一边,满足c(N2O4)为0.100mol/L即可,根据反应N2O4 2 NO2可知二氧化氮的浓度应该为:c(NO2)=2c(N2O4)=0.1mol/L×2=0.20 mol/L,故答案为:0.20 mol/L。

【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
制备K2FeO4(夹持装置略)
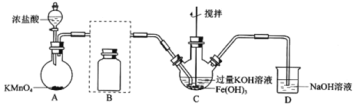
(1)A为氯气发生装置,A中反应离子方程式是:___。
(2)将除杂装置B补充完整并标明所用试剂。___。
(3)C中得到紫色固体和溶液。C中Cl2发生的反应有:3Cl2+2Fe(OH)3+10KOH→2K2FeO4+6KCl+8H2O,另外还有:___。
(4)已知Cl2与KOH在较高温度下反应生成KClO3。为了保证生产KClO,在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是:___、__。
探究K2FeO4的性质
(5)高铁酸钾常用于工业废水与城市生活污水的处理,可用作高效水处理剂,表现在水中与污染物作用的过程中,经过一系列反应,由六价降至三价后,能对水产生净化作用的原因是(结合离子方程式回答):____。
(6)取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2,为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案I | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生 |
i.由方案I中溶液变红可知a中含有__离子,但该离子的产生不能判断一定K2FeO4将Cl-氧化,还可能由___产生(用离子方程式表示)。
ii.方案II可证明K2FeO4氧化了Cl-。
(7)用KOH溶液洗涤的目的是___。
(8)根据K2FeO4的制备实验得出:氧化性Cl2__FeO42-(填“>”或“<”),而方案II实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是___。
(9)资料表明,酸性溶液中的氧化性FeO42->MnO42-,验证实验如下:
将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性FeO42->MnO42-,若能,请说明理由;若不能,进一步设计实验方案,理由或方案:__。


