题目内容
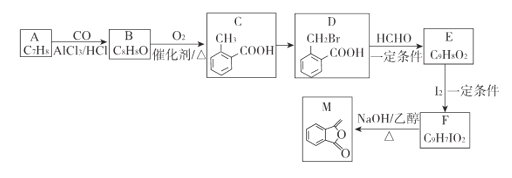
【题目】高纯MnCO3在电子工业中有重要的应用,工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如图所示:

已知:还原焙烧主反应为2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:

根据要求回答下列问题:
(1)在实验室进行步骤A,混合物应放在__________中加热。
(2)步骤E中调节pH的范围为____________,其目的是______________________________。
(3)步骤G,温度控制在35℃以下的原因是____________________________________,若Mn2+恰好沉淀完全(当离子浓度≦10-5mol/L认为该离子沉淀完全)时测得溶液中![]() 的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=____________。
的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=____________。
(4)步骤D中氧化剂与还原剂的物质的量之比为__________;步骤C中的滤渣为__________。
(5)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否干净的方法是_____________________。
(6)现用滴定法测定产品中锰元素的含量。实验步骤:称取3.300 g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnCO3完全转化为[Mn(PO4)2]3-(其中![]() 完全转化为
完全转化为![]() );加入稍过量的硫酸铵,发生反应NO2-+
);加入稍过量的硫酸铵,发生反应NO2-+![]() =N2↑+2H2O以除去
=N2↑+2H2O以除去![]() ;加入稀硫酸酸化,再加入60.00 mL 0.500 mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2
;加入稀硫酸酸化,再加入60.00 mL 0.500 mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2![]() ;用5.00 mL 0.500 mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
;用5.00 mL 0.500 mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为_____________________________________。
②试样中锰元素的质量分数为____________。
【答案】坩埚 3.7≤pH<8.1 使Fe3+转化为Fe(OH)3而除去,而不影响Mn2+ 减少碳酸氢铵的分解,提高原料利用率 2.2×10-11 1∶2 C、 Cu和CaSO4 取少量最后一次的洗涤液于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净 6Fe2++![]() +14H+=6Fe3++2Cr3++7H2O 25%
+14H+=6Fe3++2Cr3++7H2O 25%
【解析】
软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质),主要发生2MnO2+C![]() 2MnO+CO2↑,同时C将Fe2O3、CuO还原生成Fe、Cu,再用硫酸浸取过滤得到MnSO4、FeSO4溶液,过滤分离出的滤渣为过量的碳和反应生成的Cu、CaSO4;加入MnO2氧化Fe2+得到Fe3+,再调节pH除去Fe3+得到MnSO4溶液,最后用NH4HCO3发生复分解反应生成MnCO3,分离烘干得到MnCO3,以此来解答。
2MnO+CO2↑,同时C将Fe2O3、CuO还原生成Fe、Cu,再用硫酸浸取过滤得到MnSO4、FeSO4溶液,过滤分离出的滤渣为过量的碳和反应生成的Cu、CaSO4;加入MnO2氧化Fe2+得到Fe3+,再调节pH除去Fe3+得到MnSO4溶液,最后用NH4HCO3发生复分解反应生成MnCO3,分离烘干得到MnCO3,以此来解答。
(1)高温焙烧物质应在坩埚中进行;
(2)此时溶液中的杂质主要为Fe3+,结合表中数据可知为了使三价铁完全沉淀而不影响锰离子,步骤E中调节pH的范围为3.7≤pH<8.3,其目的是使铁离子转化为氢氧化铁而除去,而不影响Mn2+;
(3)铵盐不稳定,受热易分解,所以步骤G中温度需控制在35℃以下,减少碳酸氢铵的分解,提高原料利用率;Mn2+恰好沉淀完全时可认为c(Mn2+)=10-5mol/L,Ksp(MnCO3)= c(Mn2+)·c(CO32-)=10-5×2.2×10-6=2.2×10-11;
(4)步骤D中MnO2被还原成Mn2+,化合价降低2价,Fe2+被氧化成Fe3+,化合价升高1价,根据得失电子守恒,氧化剂与还原剂的物质的量之比为1:2;根据分析可知滤渣为C、Cu和CaSO4;
(5)生成的MnCO3沉淀可能附着有硫酸盐,所以检验是否含有硫酸根即可确认沉淀是否洗涤干净,具体操作为:取少量最后一次的洗涤液于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净;
(6)①酸性K2Cr2O7具有强氧化性,可以把亚铁离子氧化成铁离子,自身被还原成Cr3+,根据电子守恒、电荷守恒和原子守恒可得离子方程式为6Fe2++![]() +14H+=6Fe3++2Cr3++7H2O;
+14H+=6Fe3++2Cr3++7H2O;
②根据方程式6Fe2++![]() +14H+=6Fe3++2Cr3++7H2O可知剩余n(Fe2+)= 0.500 mol·L-1×0.005L×6=0.015mol,则与[Mn(PO4)2]3-反应的n(Fe2+)=0.500 mol·L-1×0.06L-0.015mol=0.015mol,根据方程式[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2
+14H+=6Fe3++2Cr3++7H2O可知剩余n(Fe2+)= 0.500 mol·L-1×0.005L×6=0.015mol,则与[Mn(PO4)2]3-反应的n(Fe2+)=0.500 mol·L-1×0.06L-0.015mol=0.015mol,根据方程式[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2![]() 可知n(Mn)=0.015mol,所以锰元素的质量分数为
可知n(Mn)=0.015mol,所以锰元素的质量分数为![]() ×100%=25%。
×100%=25%。

【题目】在100℃时,将0.100mol的N2O4气体充入1L抽空密闭容器中,发生反应:N2O4(g)2NO2.现在隔一定时间对该容器内的物质进行分析,得到如下表格:
t/s c/(molL﹣1) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/(molL﹣1) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2)/(molL﹣1) | 0 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试回答下列问题:
(1)达到平衡时N2O4的转化率为_____%,表中c2_____c3,a_____b(后两空选填>、<、=)
(2)20 s的N2O4的浓度c1=_____mol/L在0~20s内N2O4的平均反应速率为_____mol/(Ls);
(3)若其他反应条件以及初始物质物质的量不变,将反应的温度降低到80℃时,达到平衡时NO2的物质的量为0.100 mol,那么正反应是_____反应(选填吸热或放热)
(4)若在相同初始情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度为_____mol/L。