题目内容
15.将一定量的金属钠放入一定浓度的氢氧化钠溶液中,反应完全后,恢复到原温度,氢氧化钠的浓度( )| A. | 增大 | B. | 减小 | C. | 不变 | D. | 不能确定 |
分析 同一物质饱和溶液的浓度只与温度有关,温度不变,浓度不变,不是饱和溶液,氢氧化钠增大,则氢氧化钠浓度增大,据此分析.
解答 解:将一定量的金属钠放入一定浓度的氢氧化钠溶液中,钠与水反应生成氢氧化钠和氢气,所以当原溶液为饱和溶液,则恢复至原温度,由于温度不变,溶液的浓度不变,仍为饱和溶液,当原来不是饱和溶液,则氢氧化钠浓度增大,所以不能确定,故D正确;
故选D.
点评 本题考查了影响溶液浓度的因素,题目难度不大,侧重于基础知识的考查.

练习册系列答案
相关题目
5.下列溶液中,物质的量浓度最大的是( )
| A. | 1LH2SO4溶液中含98gH2SO4 | B. | 0.5L含49gH2SO4的溶液 | ||
| C. | 98gH2SO4溶于水配成2 L溶液 | D. | 1L含196gH2SO4的溶液 |
6.下列各组中的离子,在溶液中能大量共存的是( )
| A. | Ag+、H+、Cl-、CO32- | B. | H+、Ba2+、OH-、SO42- | ||
| C. | Ba2+、K+、Cl-、NO3- | D. | Ca2+、HCO3-、Cl-、OH- |
3.下列离子方程式中,正确的是( )
| A. | 碳酸氢钠与硫酸氢钠反应:HCO3-+HSO4-═SO42-+H2O+CO2↑ | |
| B. | 硫酸与氢氧化钡反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 锌和稀硫酸反应:Zn+2H+═Zn2++H2↑ | |
| D. | 氧化铜和盐酸反应:O2-+2H+═H2O |
10.如图与对应的叙述一定正确的是( )


| A. | ①所示,反应:X(g)+2Y(g)═3Z(g),b的压强一定比a大 | |
| B. | ②表明合成氨反应是放热反应,a表示在反应体系中加入了催化剂 | |
| C. | ③所示,t1℃时质量分数均为20%的甲、乙两种饱和溶液,升温到t2℃时,两种溶液中溶质的质量分数不再相等 | |
| D. | ④所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a |
7.X、Y、Z、W四种短周期元素,有关数据如下表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 66 | 70 | 143 | 160 |
| 主要化合价 | -2 | +5、+3、-3 | +3 | +2 |
| A. | W和Y形成的化合物中含有离子键和非极性键 | |
| B. | 一定条件下,X单质可以将Y单质从其氢化物中置换出来 | |
| C. | Z的最高价氧化物能溶于氨水 | |
| D. | Y的简单气态氢化物的沸点高于 X的简单气态氢化物 |
4.现有标准状况下的氮气5.6克,下列说法正确的是( )
| A. | 它的体积为2.24L | B. | 其摩尔体积为22.4L.mol-1 | ||
| C. | 含有氮分子数为0.4NA | D. | 其摩尔质量为28mol |
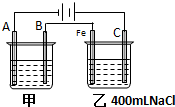 如图为相互串联的甲、乙两电解池试回答:
如图为相互串联的甲、乙两电解池试回答: