题目内容
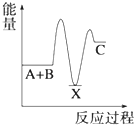
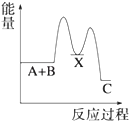
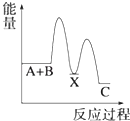
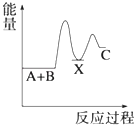
【题目】—定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是( )
C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是( )
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 1.20 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A. 该反应正反应为吸热反应
B. 达平衡时,甲、乙容器内:2c(CO2,甲)<c(CO2,乙)
C. 达平衡时,容器甲中的逆反应速率比容器乙中的大
D. 达平衡时,转化率:a(CO2,甲)+a(C2H5OH,丙)>1
【答案】D
【解析】若丙容器也在500 K时进行反应,与甲容器中的是等效,达平衡时,转化率:a(CO2,甲)+a(C2H5OH,丙)=1,而升高到600 K时,C2H5OH(g) 平衡浓度为0.039 mol/L<0.083 mol/L,说明升高温度,平衡向左移动,正反应为放热反应,A错误,达平衡时,转化率:a(CO2,甲)+a(C2H5OH,丙)>1,D正确;若乙容器扩大一倍,则此条件下与甲容器中反应是等效的,现容器压缩到原来一半,若平衡不移动,2c(CO2,甲)=c(CO2,乙),现增大压强,平衡向正方向移动,c(CO2,乙)下降,则2c(CO2,甲)>c(CO2,乙),B错误;容器甲中物质浓度小于容器乙中物质浓度,达平衡时,甲中反应速率比容器乙中的小,C错误。

【题目】某同学用15molL﹣1浓硫酸,按下列步骤配2505mL0.1molL﹣1H2SO4溶液,请回答有关问题.
(1)完成下列表格:
实验步骤 | 有关问题 |
①计算所需浓硫酸的体积 | 需取浓硫酸()mL |
②量 取浓硫酸 | 需要用到的主要仪器是: |
③将 浓硫酸并搅拌 | 该操作要做到胆大心细,杜绝事故发生 |
④待溶液冷却至室温,将烧杯中溶液转移至 mL容量瓶中 | 要注意把洗涤液一并转移至容量瓶中 |
⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1﹣2cm处后的正确操作是: |
(2)本实验不需要用到的仪器是
a.玻璃棒 b.烧杯 c.天平 d胶头滴管
(3)在进行④步操作时,不慎将溶液溅到容量瓶外,则配制溶液的浓度将(填写偏高、偏低、不影响.下同).若配制时容量瓶没有干燥,则配制溶液浓度将 .
(4)某研究人员应用如图研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸汽.请回答下列问题:
①浓硫酸的作用是 .
②通入Cl2后,从集气瓶B中干燥的有色布条的现象可得出的结论是从集气瓶C中湿润的有色布条的现象可得出的结论是 .
③从物质性质的方面来看,这样的实验设计还存在事故隐患,请在图D处以图的形式表明克服事故隐患的措施.