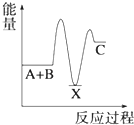
题目内容
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中.从废料中回收氧化钴(CoO)的工艺流程如下: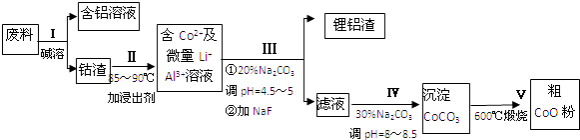
(1)为了提高废料溶浸的效率,可以采取的措施有(写一条即可)
(2)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 .
(3)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的化学反应方程式为(产物中只有一种酸根) . 在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因 .
(4)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3 , 请写出产生Al(OH)3反应的离子方程式 .
(5)碳酸钠溶液在过程Ⅲ和IV中所起作用有所不同,请写出在过程Ⅳ中起的作用是 .
(6)实验室模拟生产过程V中,必须使用的仪器,除酒精灯、三脚架外,还需、 .
【答案】
(1)搅拌、适当提高温度、粉碎、适当提高溶液浓度等
(2)2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑
(3)4Co2O3?CoO+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O;Co2O3?CoO可氧化盐酸产生Cl2 , 污染环境
(4)2Al3++3CO32﹣+3H2O=2Al(OH)3↓+3CO2↑
(5)调整pH,提供CO32﹣ , 使Co2+沉淀为CoCO3
(6)泥三角;坩埚
【解析】解:操作Ⅰ利用了铝能溶解在氢氧化钠溶液的性质,将铝从废料中分离出来,过滤后得到含Co2O3CoO的钴渣,再用酸溶解过滤后得到含Co3+及Al3+、Li+的滤液,通过调整溶液的pH得到Al(OH)3和LiF沉淀,再过滤得到含Co3+的滤液,再滴加Na2CO3溶液得到CoCO3沉淀,经过滤、洗涤沉淀,最后将CoCO3进行加热分解可得CoO粉末,(1)升高温度、搅拌、减小固体的颗粒等均能加速固体的溶解,所以为了提高溶浸工序中原料的浸出效率,可以采取的措施有:适当升高温度,搅拌,研磨矿石,适当提高稀硫酸的浓度,所以答案是:搅拌、适当提高温度、粉碎、适当提高溶液浓度等;(2)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子反应方程式为:2Al+2OH﹣+2H2O=+2AlO2﹣+3H2↑,
所以答案是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;(3)Co3O4和Na2S2O3在酸性条件下发生氧化还原反应生成CoSO4、Na2SO4和H2O,反应方程式为:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O,所以加入Na2S2O3的作用是还原Co3+ , 盐酸具有还原性,能被Co2O3CoO氧化生成有毒的氯气而污染环境,所以不能盐酸,
所以答案是:4Co2O3CoO+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O;Co2O3CoO可氧化盐酸产生Cl2 , 污染环境;(4)铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32﹣+3H2O=2Al(OH)3↓+3CO2↑,
所以答案是:2Al3++3CO32﹣+3H2O=2Al(OH)3↓+3CO2↑;(5)碳酸钠溶液在过程Ⅲ中铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳;碳酸钠溶液在过程Ⅳ中调整pH,提供CO32﹣ , 使Co2+沉淀为CoCO3 , 所以答案是:调整pH,提供CO32﹣ , 使Co2+沉淀为CoCO3;(6)过程V为加热固体,常用仪器有酒精灯、三脚架、泥三角、坩埚等,所以答案是:泥三角、坩埚.

 阅读快车系列答案
阅读快车系列答案