题目内容
2.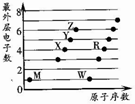 X、Y、Z、M、W、R为六种短周期元素.它们的外层电子数与原子序数关系如图所示.下列说法正确的是( )
X、Y、Z、M、W、R为六种短周期元素.它们的外层电子数与原子序数关系如图所示.下列说法正确的是( )| A. | X2M2、W2Z2均为直线型的共价化合物 | |
| B. | X能与RZ2反应生成R和XZ,证明X非金属性比R强 | |
| C. | X、Y、Z分别与M元素形成的简单化合物,其稳定性依次递减 | |
| D. | 1mol由W与M元素组成的化合物,常温下与水完全反应能生成2g气体 |
分析 都是短周期元素,由最外层电子数与原子序数关系可知,X、Y、Z处于第二周期,X、Y、Z的最外层电子数分别为4、5、6,故X为C元素、Y为N元素、Z为O元素;W、R处于第三周期,最外层电子数分别为1、4,故W为Na元素、R为Si元素;M最外层电子数为1,与X、Y、Z不再同一直线上,故M为H元素,据此进行解答.
解答 解:都是短周期元素,由最外层电子数与原子序数关系可知,X、Y、Z处于第二周期,X、Y、Z的最外层电子数分别为4、5、6,故X为C元素、Y为N元素、Z为O元素;W、R处于第三周期,最外层电子数分别为1、4,故W为Na元素、R为Si元素;M最外层电子数为1,与X、Y、Z不再同一直线上,故M为H元素.
A.X2M2、W2Z2分别为C2H2、Na2O2,前者为直线型化合物,但后者属于离子化合物,故A错误;
B.碳与二氧化硅在高温下反应生成Si和CO,温度影响物质性质,不能证明碳非金属性比Si强,故B错误;
C.X为C、Y为N、Z为O,非金属性依次增强,氢化物稳定性与元素非金属性一致,故其稳定性依次增强,故C错误;
D.由W与M元素组成的化合物为NaH,常温下与水发生反应:NaH+H2O=NaOH+H2↑,1molNaH与水完全反应能生成2g氢气,故D正确,
故选:D.
点评 本题考查结构性质位置关系应用,根据最外层电子数及原子序数的关系确定元素是解题的关键,注意M元素的推断,D选项为易错点,中学基本不涉及金属氢化物,难度中等.

练习册系列答案
相关题目
12.2009年3月22日 是第17届世界水日(world water day).自水生产中通常使用少量氯气进行杀菌消毒,氯气与水反应的产物之一是盐酸.市场上有些不法商贩为牟取暴利,用自水冒充纯净水(蒸馏水)出售.为辨别真伪,可用下列一种化学试剂鉴别,该试剂是( )
| A. | 酚酞试液 | B. | 氯化钡溶液 | C. | 氢氧化钠溶液 | D. | 硝酸银溶液 |
10.氯化铁溶液蒸干灼烧,最后得到的固体产物是( )
| A. | 无水氯化铁 | B. | 氢氧化铁 | C. | 氧化亚铁 | D. | 氧化铁 |
14. (1)已知元素M是组成物质NH4Al(SO4)2的一种元素.元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如表所示:
(1)已知元素M是组成物质NH4Al(SO4)2的一种元素.元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如表所示:
元素M的名称是铝.
(2)不同元素的原子在分子内吸引电子的能力大小可用电负性来表示,下面是某些短周期元素电负性:
①通过分析电负性变化规律,确定Mg的电负性(用x表示)最小取值范围:0.9<x<1.57.
②某有机化合物结构式为 ,其中S-N中,你认为共用电子对偏向谁?氮(写原子名称)
,其中S-N中,你认为共用电子对偏向谁?氮(写原子名称)
③已知元素电负性的差值一般大于1.7时,原子间形成离子键,小于该值则原子间形成共价键,请指出下列原子之间形成的化学键是离子键还是共价键.Be和F离子键,Si和Cl共价键.
(3)工业上冶炼Z时用到的催化剂是冰晶石,制取冰晶石(Na3AlF6)的化学方程式如下:
2Al(OH)3+12HF+3A═2Na3AlF6+3CO2↑+9H2O
①反应物A的化学式为 Na2CO3,属于离子晶体
②冰晶石(Na3AlF6)是离子化合物,由两种微粒构成,冰晶石晶胞结构如图所示,“●”位于大立方体顶点和面心,“○”位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处“▽”所代表的微粒是Na+(填具体的微粒符号)
③若Na3AlF6的摩尔质量为Mg/mol,若该晶胞的边长为acm,密度为ρg/cm3,设NA表示阿伏伽德罗常数,则NA=$\frac{4M}{ρ{a}^{3}}$/mol(用M、a、ρ表示).
 (1)已知元素M是组成物质NH4Al(SO4)2的一种元素.元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如表所示:
(1)已知元素M是组成物质NH4Al(SO4)2的一种元素.元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如表所示:| I1 | I2 | I3 | I4 | |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 |
(2)不同元素的原子在分子内吸引电子的能力大小可用电负性来表示,下面是某些短周期元素电负性:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性 | 1.0 | 1.57 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.61 | 1.8 | 2.1 | 2.5 | 3.0 |
②某有机化合物结构式为
 ,其中S-N中,你认为共用电子对偏向谁?氮(写原子名称)
,其中S-N中,你认为共用电子对偏向谁?氮(写原子名称)③已知元素电负性的差值一般大于1.7时,原子间形成离子键,小于该值则原子间形成共价键,请指出下列原子之间形成的化学键是离子键还是共价键.Be和F离子键,Si和Cl共价键.
(3)工业上冶炼Z时用到的催化剂是冰晶石,制取冰晶石(Na3AlF6)的化学方程式如下:
2Al(OH)3+12HF+3A═2Na3AlF6+3CO2↑+9H2O
①反应物A的化学式为 Na2CO3,属于离子晶体
②冰晶石(Na3AlF6)是离子化合物,由两种微粒构成,冰晶石晶胞结构如图所示,“●”位于大立方体顶点和面心,“○”位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处“▽”所代表的微粒是Na+(填具体的微粒符号)
③若Na3AlF6的摩尔质量为Mg/mol,若该晶胞的边长为acm,密度为ρg/cm3,设NA表示阿伏伽德罗常数,则NA=$\frac{4M}{ρ{a}^{3}}$/mol(用M、a、ρ表示).
11.下列叙述正确的是( )
| A. | 第VIIA族元素由上至下其单质的沸点依次升高 | |
| B. | 第VIA族元素的最高化合价都为+6价 | |
| C. | 离核越远的电子层上的电子能量越低 | |
| D. | 所有元素的原子中都含有中子 |
12.某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼脂)研究电化学原理,下列叙述正确的是( )

| A. | 用稀硫酸代替AgNO3溶液,也可形成原电池 | |
| B. | 银片为负极,发生的反应为:Ag++e-=Ag | |
| C. | 进行实验时,琼脂中K+移向Mg(NO3)2溶液 | |
| D. | 取出盐桥,电流表依然有偏转 |