题目内容
17.若25℃时,CH3COOH的电离平衡常数Ka=1.8×10-5,则该温度下0.18mol/L的CH3COONa溶液的pH=9(CH3COONa水解程度很小,计算时可将CH3COO-的平衡浓度看成是CH3COONa溶液的浓度)分析 醋酸钠水解离子方程式为CH3COO-+H2O=CH3COOH+OH-,设溶液中c(OH-)=xmol/L,CH3COONa水解程度很小,计算时可将CH3COO-的平衡浓度看成是CH3COONa溶液的浓度,所以该溶液水解平衡常数K=$\frac{c(O{H}^{-})c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$=$\frac{{K}_{w}}{{K}_{a}}$=$\frac{{x}^{2}}{0.18}$=$\frac{1{0}^{-14}}{1.8×1{0}^{-5}}$,x=10-5,溶液中c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{1{0}^{-5}}$mol/L=10-9mol/L,pH=-lgc(H+).
解答 解:醋酸钠水解离子方程式为CH3COO-+H2O=CH3COOH+OH-,设溶液中c(OH-)=xmol/L,CH3COONa水解程度很小,计算时可将CH3COO-的平衡浓度看成是CH3COONa溶液的浓度,所以该溶液水解平衡常数K=$\frac{c(O{H}^{-})c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$=$\frac{{K}_{w}}{{K}_{a}}$=$\frac{{x}^{2}}{0.18}$=$\frac{1{0}^{-14}}{1.8×1{0}^{-5}}$,x=10-5,溶液中c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{1{0}^{-5}}$mol/L=10-9mol/L,pH=-lgc(H+)=-lg10-9=9,故答案为:9.
点评 本题考查pH简单计算,侧重考查学生分析推断及计算能力,明确离子积常数与电离平衡常数、水解平衡常数关系是解本题关键,注意醋酸根离子及醋酸分子、氢氧根离子近似处理方法,题目难度中等.

| A. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | AlCl3溶液中加过量氨水:Al3++4NH3•H2O═AlO2-↓+4NH4++2H2O | |
| C. | 小苏打置于盐酸中:CO32-+2H+═CO2↑+H2O | |
| D. | 过量CO2通入漂白粉溶液中:CO2+H2O+ClO-═HCO3-+HClO |
| A. | 2.3 g钠与水反应产生氢气的分子数为0.05NA | |
| B. | 1 mol Fe与过量的稀HNO3反应,转移2NA个电子 | |
| C. | 0.1 mol/LNa2SO4溶液含有0.1NA个SO42- | |
| D. | 22.4 L氯气与足量铜充分反应,生成1 mol CuCl2 |
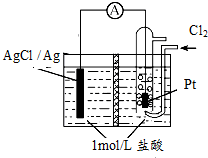 某原电池装置如图所示,中间是某种离子交换膜,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )
某原电池装置如图所示,中间是某种离子交换膜,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )| A. | 电池放电时的负极反应为Ag-e-=Ag+ | |
| B. | 若使用阳离子交换膜,当电路中转移0.01 mol e-时,交换膜左侧溶液质量减少36.5g | |
| C. | 以Pt作电极,除了导电之外,还有催化剂的作用 | |
| D. | 用该电池给铅蓄电池充电,若有11.2L的Cl2参加电池反应,则理论上铅蓄电池的负极质量增加48g |
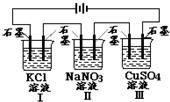 如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为 (溶液足量,体积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计)( )
如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为 (溶液足量,体积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计)( )| A. | 13、7、1 | B. | 12、7、2 | C. | 1、7、13 | D. | 7、13、1 |
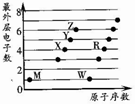 X、Y、Z、M、W、R为六种短周期元素.它们的外层电子数与原子序数关系如图所示.下列说法正确的是( )
X、Y、Z、M、W、R为六种短周期元素.它们的外层电子数与原子序数关系如图所示.下列说法正确的是( )| A. | X2M2、W2Z2均为直线型的共价化合物 | |
| B. | X能与RZ2反应生成R和XZ,证明X非金属性比R强 | |
| C. | X、Y、Z分别与M元素形成的简单化合物,其稳定性依次递减 | |
| D. | 1mol由W与M元素组成的化合物,常温下与水完全反应能生成2g气体 |
| A. | Na2O2能与CO2反应,可用作呼吸面具的供氧剂 | |
| B. | 硅是半导体材料,可用于制备光导纤维 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 |
| A. | NH4Cl溶液中:c(Cl-)=c(NH4+) | |
| B. | NaHCO3溶液中:c(H+)+c(Na+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 常温下,醋酸钠溶液中滴加少量醋酸使溶液的pH=7,混合溶液中:c(Na+)<c(CH3COO-) | |
| D. | Na2CO3溶液中:c(HCO3-)+c(H2CO3)+c(CO32-)=$\frac{1}{2}$c(Na+) |
 .
.