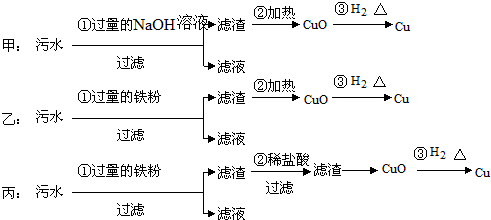
题目内容
10.氯化铁溶液蒸干灼烧,最后得到的固体产物是( )| A. | 无水氯化铁 | B. | 氢氧化铁 | C. | 氧化亚铁 | D. | 氧化铁 |
分析 FeCl3溶液在加热时水解生成Fe(OH)3,Fe(OH)3灼烧分解生成Fe2O3,以此解答该题.
解答 解:在FeCl3溶液中,Fe3+发生水解生成Fe(OH)3:FeCl3+3H2O?Fe(OH)3+3HCl,由于加热蒸发,使HCl挥发,破坏平衡,使平衡不断向右移动,结果生成Fe(OH)3,又由于灼热使Fe(OH)3分解生成Fe2O3.2Fe(OH)3$\frac{\underline{\;加热\;}}{\;}$Fe2O3+3H2O,
故选D.
点评 本题考查盐类水解的应用,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握水解的原理及应用.

练习册系列答案
相关题目
20.可以区别苯酚、乙醇、氢氧化钠、硝酸银、硫氰化钾五种溶液的一种试剂是( )
| A. | 溴水 | B. | 新制Cu(OH)2 | C. | FeCl3溶液 | D. | 金属钠 |
18.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14.X 与Y、Z位于相邻周期,X原子内层电子数与Y原子最外层电子数相等,Z原子最外层电子数比X的最外层电子数多2.下列说法正确的是( )
| A. | Y的氧化物是离子化合物 | |
| B. | X的氢化物溶于水显酸性 | |
| C. | 常温时Z单质的氧化性比X单质的氧化性弱 | |
| D. | X和 Z的最高价氧化物对应的水化物都是弱酸 |
5.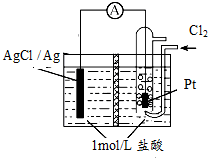 某原电池装置如图所示,中间是某种离子交换膜,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )
某原电池装置如图所示,中间是某种离子交换膜,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )
 某原电池装置如图所示,中间是某种离子交换膜,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )
某原电池装置如图所示,中间是某种离子交换膜,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )| A. | 电池放电时的负极反应为Ag-e-=Ag+ | |
| B. | 若使用阳离子交换膜,当电路中转移0.01 mol e-时,交换膜左侧溶液质量减少36.5g | |
| C. | 以Pt作电极,除了导电之外,还有催化剂的作用 | |
| D. | 用该电池给铅蓄电池充电,若有11.2L的Cl2参加电池反应,则理论上铅蓄电池的负极质量增加48g |
15.在一定温度和压强条件下发生了反应:CO2(g)+3H2 (g)?CH3OH(g)+H2O(g)△H<0,反应达到平衡时,改变温度(T)和压强(p),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(p)的关系判断正确的是( )

| A. | P3>P2 T3>T2 | B. | P2>P4 T4>T2 | C. | P1>P3 T3>T1 | D. | P1>P4 T2>T3 |
2.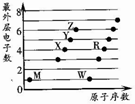 X、Y、Z、M、W、R为六种短周期元素.它们的外层电子数与原子序数关系如图所示.下列说法正确的是( )
X、Y、Z、M、W、R为六种短周期元素.它们的外层电子数与原子序数关系如图所示.下列说法正确的是( )
 X、Y、Z、M、W、R为六种短周期元素.它们的外层电子数与原子序数关系如图所示.下列说法正确的是( )
X、Y、Z、M、W、R为六种短周期元素.它们的外层电子数与原子序数关系如图所示.下列说法正确的是( )| A. | X2M2、W2Z2均为直线型的共价化合物 | |
| B. | X能与RZ2反应生成R和XZ,证明X非金属性比R强 | |
| C. | X、Y、Z分别与M元素形成的简单化合物,其稳定性依次递减 | |
| D. | 1mol由W与M元素组成的化合物,常温下与水完全反应能生成2g气体 |