题目内容
12.某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼脂)研究电化学原理,下列叙述正确的是( )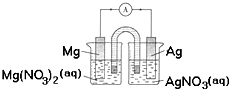
| A. | 用稀硫酸代替AgNO3溶液,也可形成原电池 | |
| B. | 银片为负极,发生的反应为:Ag++e-=Ag | |
| C. | 进行实验时,琼脂中K+移向Mg(NO3)2溶液 | |
| D. | 取出盐桥,电流表依然有偏转 |
分析 镁比银活泼,形成原电池反应时,镁为负极,被还原,电极方程式为Mg-2e-=Mg2+,银为正极,发生还原反应,电极方程式为Ag++e-=Ag,原电池工作时,阳离子向正极移动,阴离子向负极移动,以此解答该题.
解答 解:A.用稀硫酸代替AgNO3溶液,正极析出氢气,可形成原电池,故A正确;
B.银不如镁活泼,银为正极,正极发生还原反应,电极方程式为Ag++e-=Ag,故B错误;
C.原电池工作时,阳离子向正极移动,所以K+移向AgNO3溶液,故C错误;
D.取出盐桥,不能形成闭合回路,不能产生电流,故D错误.
故选A.
点评 本题考查原电池知识,为高频考点,侧重于学生分析能力和基本理论的理解和运用的考查,注意把握金属的活泼性强弱以及电极方程式的书写,难度不大.

练习册系列答案
相关题目
2.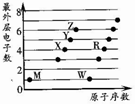 X、Y、Z、M、W、R为六种短周期元素.它们的外层电子数与原子序数关系如图所示.下列说法正确的是( )
X、Y、Z、M、W、R为六种短周期元素.它们的外层电子数与原子序数关系如图所示.下列说法正确的是( )
 X、Y、Z、M、W、R为六种短周期元素.它们的外层电子数与原子序数关系如图所示.下列说法正确的是( )
X、Y、Z、M、W、R为六种短周期元素.它们的外层电子数与原子序数关系如图所示.下列说法正确的是( )| A. | X2M2、W2Z2均为直线型的共价化合物 | |
| B. | X能与RZ2反应生成R和XZ,证明X非金属性比R强 | |
| C. | X、Y、Z分别与M元素形成的简单化合物,其稳定性依次递减 | |
| D. | 1mol由W与M元素组成的化合物,常温下与水完全反应能生成2g气体 |
3.25℃时,0.1mol/L的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=l×l06,下列叙述正确的是( )
| A. | 该溶液中由水电离出的c(H+)=l×10-13mol/L | |
| B. | 0.1mol•L-1 HA溶液与0.05mol•L-1 NaOH溶液等体积混合后所得溶液中:c(H+)+c(Na+)=c(OH-)+c(A-) | |
| C. | 由pH=4的HA与pH=10的NaOH溶液等体积混合,溶液中c(Na+)>c(A-)>c(OH一)>c(H+) | |
| D. | 浓度均为0.1mol/L的HA和NaA溶液等体积混合,若溶液呈酸性,则:c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-) |
7.下列关于溶液中离子浓度关系正确的是( )
| A. | NH4Cl溶液中:c(Cl-)=c(NH4+) | |
| B. | NaHCO3溶液中:c(H+)+c(Na+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 常温下,醋酸钠溶液中滴加少量醋酸使溶液的pH=7,混合溶液中:c(Na+)<c(CH3COO-) | |
| D. | Na2CO3溶液中:c(HCO3-)+c(H2CO3)+c(CO32-)=$\frac{1}{2}$c(Na+) |
17.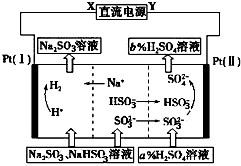 用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )
 用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )| A. | X为直流电源的负极,Y为直流电源的正极 | |
| B. | 阳极区pH增大 | |
| C. | 图中的b>a | |
| D. | 该过程中的产品还有H2SO4 |
4.根据表中信息判断,下列选项中正确的是( )
| 序号 | 反应物 | 产物 |
| 1 | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| 2 | Cl2、FeBr2 | FeCl3、FeBr3 |
| 3 | MnO4-、Cl-… | Cl2、Mn2+… |
| A. | 第1组反应的其余产物只有H2O | |
| B. | 第2组反应中Cl2与FeBr2的物质的量之比可能等于1:2 | |
| C. | 第3组反应中生成22.4L,一定转移电子2mol | |
| D. | 氧化性由强到弱的顺序为MnO4->Cl2>Fe3+>Br2 |
1.NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 0.2mol•L-1 Na2SO4溶液中含有0.4NA个Na | |
| B. | 在标准状况下,NA个C02分子与NA个H2SO4分子所占的体积之比为1:1 | |
| C. | 5.6g铁在足量氯气中燃烧时失去的电子数目为0.2NA | |
| D. | 常温常压下,64g SO2中含有的原子数为3NA |
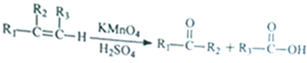 由
由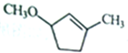 到
到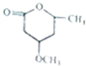 的合成路线如下所示:
的合成路线如下所示: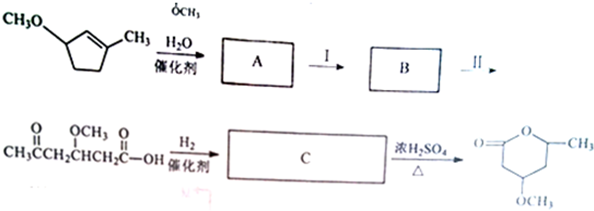
 ;B
;B ;C
;C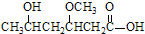 .
.