题目内容
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为__。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
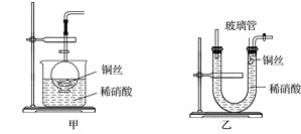
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是__(填字母)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是__。
②让反应停止的操作方法及原因是__。
(4)以下收集NO气体的装置,合理的是__(填字母)。
A. B.
B.![]() C.
C. D.
D.![]() E.
E.![]()
【答案】3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑ CD 2NO+O2=2NO2 接收被气体压出U形管的液体,防止稀硝酸溢出 关闭U形管右端导气管上的活塞;反应产生的气体将U形管右端管内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止 CD
【解析】
(1)Cu与硝酸反应生成硝酸铜、NO和水,以此书写离子反应;
(2)①根据试验的目的是证明金属铜和硝酸之间的反应,根据目的选择所用的材料;
②图1中试管内有空气,NO被氧化为红棕色的气体;
(3)根据一氧化氮的溶解性和装置的特点解答;
(4)根据一氧化氮的溶解性与氧气的反应确定收集方法。
(1)金属铜可以和稀硝酸之间反应生成硝酸铜、一氧化氮以及水,即3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑,
故答案为:3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑;
(2)①若实验室没有铜丝,以铜粒代替铜丝进行实验,由于铁和铝的活泼性均强于铜,其先与硝酸发生反应,因此,不能用铁丝和铝丝包裹铜粒。由于玻璃和铂不与硝酸反应,可以用其包裹铜粒,故选CD;
②试管内有空气,NO容易被氧化为红棕色的气体二氧化氮,即2NO+O2═2NO2,故答案为:2NO+O2═2NO2;
(3)①一氧化氮是微溶于水的气体,当制取一氧化氮的装置产生一氧化氮气体时,若关闭出气口,气体可把U形管中的液体压出,因此,长玻璃管的作用为:接收被气体压出U形管的液体,防止稀硝酸溢出;
②让反应停止,则应该使铜和稀硝酸分开,具体操作方法及原因是关闭U形管右端导气管上的活塞,反应产生的气体将U形管右端内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止,故答案为:关闭U形管右端导气管上的活塞;反应产生的气体将U形管右端内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止;
(4)由于一氧化氮与氧气在常温下反应生成二氧化氮,故不能用排空法收集,所以只能用排水法,故C正确,而D和E排水法收集装置,应该短进长出,所以D正确,E错误,故选:CD。