题目内容
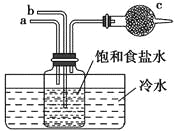
【题目】在标准状况下,三个干燥的烧瓶内分别装入:干燥纯净的氨气、含有部分空气的氯化氢气体、体积比为4∶1的二氧化氮与氧气的混合气体。分别做喷泉实验,最终三个烧瓶中所得溶液的物质的量浓度(假设溶液不外渗)之比为( )
A.2∶1∶2B.5∶5∶4C.1∶1∶1D.无法确定
【答案】B
【解析】
假设NH3、HCl、NO2的物质的量均为1mol,氨气完全溶于水,氨气体积与氨水溶液的体积相等,则溶液体积为22.4L,故溶液浓度为![]() mol/L;氯化氢气体完全溶于水,HCl体积与形成盐酸的体积相等,则溶液体积为22.4L,故溶液浓度为
mol/L;氯化氢气体完全溶于水,HCl体积与形成盐酸的体积相等,则溶液体积为22.4L,故溶液浓度为![]() mol/L;体积比为4∶1 NO2与O2的混合气体溶于水,发生反应:4NO2+O2+2H2O=4HNO3,由方程式可知,二者恰好反应,形成硝酸溶液体积等于NO2、O2混合气体总体积,则溶液总体积为1mol×
mol/L;体积比为4∶1 NO2与O2的混合气体溶于水,发生反应:4NO2+O2+2H2O=4HNO3,由方程式可知,二者恰好反应,形成硝酸溶液体积等于NO2、O2混合气体总体积,则溶液总体积为1mol×![]() ×22.4L/mol=
×22.4L/mol=![]() ×22.4L,则硝酸溶液浓度为
×22.4L,则硝酸溶液浓度为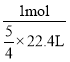 =
=![]() ×
×![]() mol/L,故三个烧瓶中所得溶液的物质的量浓度为1∶1∶
mol/L,故三个烧瓶中所得溶液的物质的量浓度为1∶1∶![]() =5∶5∶4,故选B。
=5∶5∶4,故选B。

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目