题目内容
【题目】KMnO4常用作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等。
(1)在K2MnO4溶液中通入CO2可制得高锰酸钾,副产物是黑色沉淀M。该反应中氧化剂与还原剂的质量之比为__________________。由锂离子有机高聚物、锂及M构成原电池,电池反应为Li+M=LiM(s),消耗8.7gM时转移0.1mol电子。则该电池正极的电极反应为___________________________________。
(2)实验室用KMnO4制备O2和Cl2。取0.4mol KMnO4固体加热一段时间后,收集到
amolO2,在反应后的残留固体中加入足量浓盐酸,加热又收集到bmolCl2。设锰元素全部
转化成Mn2+存在于溶液中,当a+b=0.8mol时,在标准状况下生成Cl2的体积为______L;
(3)电解K2MnO4溶液加以制备KMnO4。工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4 ,化学方程式为_______________________________。用镍片作阳极(镍不参与反应),铁板为阴极,电解K2MnO4溶液可制备KMnO4。上述过程用流程图表示如下:
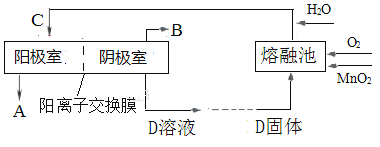
则D的化学式为___________;阳极的电极反应式为_____________________;阳离子迁移方向是___________________。
(4)高锰酸钾在酸性介质中还原产物为Mn2+,废液中c(Mn2+)浓度较大时会污染水体。实验室可以用过二硫酸铵[(NH4)2S2O8]溶液检验废水中Mn2+,实验现象是溶液变紫红色(还原产物为SO42-)。过二硫酸可以看成是H2O2的衍生物,过二硫酸铵中含有过氧键(-O-O-)。写出检验Mn2+的离子方程式_________________________________。如果将这个反应设计成盐桥原电池,盐桥中溶液最好选用______________。(选填:饱和KCl溶液、饱和K2SO4溶液或饱和NH4Cl溶液)
【答案】 1︰2 MnO2+e-+Li+= LiMnO2 13.44 2MnO2+4KOH +O2![]() 2K2MnO4+2H2O KOH MnO42--e-= MnO4- K+由阳离子交换膜左侧向右侧迁移 2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+ 饱和K2SO4溶液
2K2MnO4+2H2O KOH MnO42--e-= MnO4- K+由阳离子交换膜左侧向右侧迁移 2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+ 饱和K2SO4溶液
【解析】(1)由已知,反应物为K2MnO4、CO2,生成KMnO4,根据C原子守恒,生成物还应有K2CO3,黑色固体M必为MnO2,所以的化学方程式为:3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO3;由化学反应方程式分析可得:氧化剂和还原剂均为K2MnO4,氧化剂与还原剂的质量比为1:2;由锂离子有机高聚物、锂及MnO2构成原电池,电池反应为Li+MnO2=LiMnO2(s),负极上发生失电子的氧化反应:Li-e﹣=Li+,正极上发生得电子的还原反应:MnO2+e﹣+Li+=LiMnO2,故答案为:1:2;MnO2+e﹣+Li+=LiMnO2。
(2)Mn元素由+7价降为+2价,O元素由-2价升为0价,Cl元素由-1价升为0价,由题意根据得失电子守恒,整个过程中,Mn元素获得的电子等于O元素、Cl元素失去的电子,则有:0.4mol×(7﹣2)=4a+2b=2mol;又因为a+b=0.8mol,解得a=0.2,b=0.6,所以生成标准状况下Cl2的体积为0.6mol×22.4L/mol=13.44L。
(3)由已知,软锰矿(主要成分是MnO2)与KOH小火加热至熔融,得到K2MnO4,Mn元素化合价由+4价升为+6价,则空气中的O2作氧化剂,化学方程式为:2MnO2+4KOH+O2![]() 2K2MnO4+2H2O;电解锰酸钾溶液时阴极上水得电子生成氢气和氢氧根离子,电极反应式为:2H2O+2e﹣=H2↑+2OH﹣,K+通过阳离子交换膜由左侧向右侧迁移,所以D是氢氧化钾溶液,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为:MnO42﹣﹣e﹣=MnO4﹣。
2K2MnO4+2H2O;电解锰酸钾溶液时阴极上水得电子生成氢气和氢氧根离子,电极反应式为:2H2O+2e﹣=H2↑+2OH﹣,K+通过阳离子交换膜由左侧向右侧迁移,所以D是氢氧化钾溶液,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为:MnO42﹣﹣e﹣=MnO4﹣。
(4)由已知,在酸性介质中,Mn2+被(NH4)2S2O8溶液氧化为MnO4﹣,还原产物为SO42-,所以离子方程式为:2Mn2++5S2O82﹣+8H2O=2MnO4﹣+10SO42﹣+16H+;因为(NH4)2S2O8溶液具有强氧化性,所以如果将这个反应设计成盐桥原电池,盐桥中溶液最好选用不能被氧化的物质,可以选择饱和K2SO4溶液。