题目内容
【题目】向 ![]() 溶液中逐滴加入稀硫酸。请完成下列问题:
溶液中逐滴加入稀硫酸。请完成下列问题:
(1)写出反应的离子方程式:__________________________。
(2)下列三种情况下,离子方程式与(1)相同的是__________(填序号)。
A. 向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液至溶液显中性
溶液至溶液显中性
B. 向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液至
溶液至![]() 恰好完全沉淀
恰好完全沉淀
C. 向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液至沉淀完全
溶液至沉淀完全
(3)若缓缓加入稀硫酸至过量,整个过程中混合溶液的导电能力可以近似地用图中的_____(填序号)曲线表示。
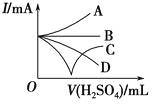
【答案】 ![]()
![]()
![]() A C
A C
【解析】试题分析:本题考查离子方程式的书写,溶液导电能力强弱的判断。
(1)Ba(OH)2和稀硫酸反应的化学方程式为:Ba(OH)2+H2SO4=BaSO4↓+2H2O,离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O。
(2)A项,反应后溶液呈中性,反应的化学方程式为:2NaHSO4+Ba(OH)2=Na2SO4+BaSO4↓+2H2O,离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,与(1)中相同;B项,反应后SO42-恰好完全沉淀,反应的化学方程式为:NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O,与(1)中不同;C项,沉淀完全即Ba(OH)2与NaHSO4等物质的量反应,反应的化学方程式为:NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O,与(1)中不同;答案选A。
(3)Ba(OH)2溶液为强碱的水溶液,开始时溶液中Ba2+、OH-浓度大,溶液的导电性强;当缓缓加入稀硫酸,OH-与H+结合成难电离的H2O,Ba2+与SO42-结合成难溶的BaSO4,溶液中离子浓度减小,溶液的导电性减弱;当两者恰好完全反应时导电性最弱接近0;继续加稀硫酸,过量的稀硫酸电离出H+和SO42-,离子浓度又变大,导电性又增强;答案选C。

 阅读快车系列答案
阅读快车系列答案
