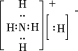题目内容
【题目】一定温度下,在容积为V L的密闭容器里进行反应,M、N的物质的量随时间的变化曲线如图所示,且两者都为气体:
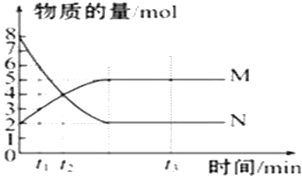
(1)此反应的化学方程式为__________________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:__________________。
(3)达平衡时N的转化率为:_______________ ;
(4)反应前与达平衡时容器内压强之比为_____________。
【答案】 2N![]() M
M ![]() molL-1min-1 75% 10:7
molL-1min-1 75% 10:7
【解析】(1)根据物质的量的变化判断反应物和生成物;根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)根据v=![]() 计算反应速率v(M);
计算反应速率v(M);
(3)根据N的转化率=![]() ×100%计算;
×100%计算;
(4)根据反应前与达平衡时容器内压强之比等于物质的量之比解答。
(1)由图像可知,随着反应进行,N的物质的量减少,M的物质的量增加,所以,N是反应物,M是生成物,随时间进行,N的物质的量为定值且不为零,反应为可逆反应,且△n(N):△n(M)=(8-2)mol:(5-2)mol=2:1,则反应的化学方程式为:2N![]() M,故答案为:2N
M,故答案为:2N![]() M;
M;
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:v=![]() =
=![]() =
=![]() molL-1min-1,故答案为:
molL-1min-1,故答案为:![]() molL-1min-1;
molL-1min-1;
(3)根据图像,N的转化率=![]() ×100%=
×100%=![]() ×100%=75%,故答案为:75%;
×100%=75%,故答案为:75%;
(4)反应前与达平衡时容器内压强之比等于物质的量之比=![]() =
=![]() ,故答案为:
,故答案为:![]() 。
。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案【题目】在2 L密闭容器内,800℃时反应:2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=______________已知:K300℃>K350℃,则该反应是_______热反应图中表示NO2变化的曲线是__________上述反应在第5s时,NO的转化率为_________。
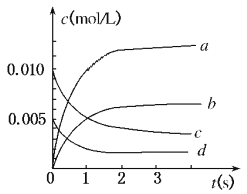
(2)能说明该反应已达到平衡状态的是__________
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)⑧的原子结构示意图为_________。
(2)②的气态氢化物分子的结构式为_____________。
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是________________。(填化学式)
(4)⑤、⑥元素的金属性强弱依次为___________。(填“增大”、“减小”或“不变”)
(5)④、⑤、⑥的形成的简单离子半径依次_______。(填“增大”、“减小”或“不变”)
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式:_______。