题目内容
【题目】可逆反应A(g)+2B(g)![]() 2C(g) △H<0,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
2C(g) △H<0,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
(1)升高温度,B的转化率___________,v(正)__________。
(2)使用催化剂,A的物质的量___________。
(3)增大压强,v(逆)___________,C的产率___________。
(4)增大A的浓度,则B的转化率____________,C的物质的量_______。
【答案】 减小 增大 不变 增大 增大 增大 增大
【解析】根据外界条件对反应速率和化学平衡的影响结合反应的方程式解答。
反应A(g)+2B(g)![]() 2C(g) △H<0是体积减小的放热的可逆反应。则
2C(g) △H<0是体积减小的放热的可逆反应。则
(1)升高温度,平衡向逆反应方向进行,所以B的转化率减小,v(正)增大;
(2)使用催化剂,只能改变反应速率,不能改变平衡状态,因此A的物质的量不变;
(3)增大压强,v(逆)增大,平衡向正反应方向进行,则C的产率增大;
(4)增大A的浓度,平衡向正反应方向进行,则B的转化率增大,C的物质的量增大。

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案【题目】在温度为T时,向2.0 L恒容密闭容器中充入1.0 molA和1.0 molB,发生反应A(g)+B(g)![]() C(g),一段时间后达到平衡。测定得部分数据见下表:
C(g),一段时间后达到平衡。测定得部分数据见下表:
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
回答下列问题:
(1)反应前5 s的平均反应速率v(A)=____________。
(2)温度为T时,达到平衡后B物质的量的浓度=________。
(3)升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH_______(填“>0”或“<0”)。
(4)下列措施能增大反应速率,且平衡向正反应方向移动是__________。
a.及时分离出A气体 b.适当升高温度
c.增大B的浓度 d.选择高效催化剂
【题目】碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl)制备碱式碳酸铜,其制备过程如下:
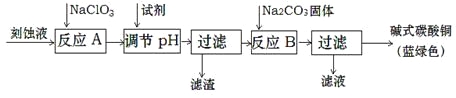
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
开始沉淀pH | 4.2 | 5.8 | 1.2 |
完全沉淀pH | 6.7 | 8.3 | 3.2 |
①氯酸钠的作用是 ;
②反应A后调节溶液的pH范围应为 。
③第一次过滤得到的产品洗涤时,如何判断已经洗净? 。
④造成蓝绿色产品中混有CuO杂质的原因是 。
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。

①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏的有 。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因 。此时B装置中发生反应的离子方程式是___________ _____。
③写出A溶液中具有强氧化性微粒的化学式 。若向A溶液中加入NaHCO3粉末,会观察到的现象是 。