题目内容
实验室制取氯气的反应是:MnO2(固)+4HCl(浓)
MnCl2+Cl2↑+2H2O如图是马虎同学设计的在实验室中制取氯气的实验装置图.
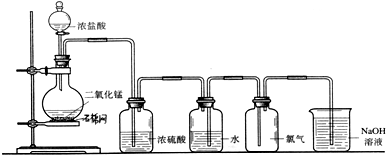
(1)在图中改正装置中的错误(三处). 、 、
(2)盛水的洗气瓶的作用是 ;盛NaOH溶液的烧杯的作用是 ,反应的离子方程式是 .
(3)设计一个最简单的实验:证明Cl2没有漂白性,HClO具有漂白性. .
| ||

(1)在图中改正装置中的错误(三处).
(2)盛水的洗气瓶的作用是
(3)设计一个最简单的实验:证明Cl2没有漂白性,HClO具有漂白性.
考点:氯气的实验室制法
专题:
分析:(1)二氧化锰和浓盐酸制取氯气需要加热,洗气装置中导气管遵循“长进短出”原则,装置中应该先除杂后干燥;
(2)HCl极易溶于水,水的作用是除去HCl;氯气有毒不能直接排空,用氢氧化钠溶液吸收氯气;
(3)将干燥气体通入干燥和湿润的有色布条中做对比实验.
(2)HCl极易溶于水,水的作用是除去HCl;氯气有毒不能直接排空,用氢氧化钠溶液吸收氯气;
(3)将干燥气体通入干燥和湿润的有色布条中做对比实验.
解答:
解:(1)二氧化锰和浓盐酸制取氯气需要加热,常温下二者不反应;洗气装置盛水的装置中导气管遵循“长进短出”原则且应该用饱和食盐水除杂;装置中应该先除杂后干燥,次序颠倒,
故答案为:没有加热;水中导气管短进长出,应该用饱和食盐水除杂;除杂顺序错误;
(2)浓盐酸具有挥发性,加热促进挥发,导致制取的氯气中含有HCl杂质,HCl极易溶于水,除去氯气中的氯化氢应该用饱和食盐水,所以水的作用是除去HCl;
氯气有毒不能直接排空,用氢氧化钠溶液吸收氯气;离子方程式为2OH-+Cl2=Cl-+ClO-+H2O;
故答案为:除去HCl气体;吸收尾气;2OH-+Cl2=Cl-+ClO-+H2O;
(3)将干燥气体通入干燥和湿润的有色布条中做对比实验,其设计方案为:将有色布条的下端用蒸馏水润湿,上端干燥,然后放入集气瓶中,下端褪色、上端不褪色,说明氯气没有漂白性,次氯酸才有漂白性,
故答案为:将有色布条的下端润湿,放入集气瓶中,下端褪色,上端不褪色,说明氯气没有漂白性,次氯酸才有漂白性.
故答案为:没有加热;水中导气管短进长出,应该用饱和食盐水除杂;除杂顺序错误;
(2)浓盐酸具有挥发性,加热促进挥发,导致制取的氯气中含有HCl杂质,HCl极易溶于水,除去氯气中的氯化氢应该用饱和食盐水,所以水的作用是除去HCl;
氯气有毒不能直接排空,用氢氧化钠溶液吸收氯气;离子方程式为2OH-+Cl2=Cl-+ClO-+H2O;
故答案为:除去HCl气体;吸收尾气;2OH-+Cl2=Cl-+ClO-+H2O;
(3)将干燥气体通入干燥和湿润的有色布条中做对比实验,其设计方案为:将有色布条的下端用蒸馏水润湿,上端干燥,然后放入集气瓶中,下端褪色、上端不褪色,说明氯气没有漂白性,次氯酸才有漂白性,
故答案为:将有色布条的下端润湿,放入集气瓶中,下端褪色,上端不褪色,说明氯气没有漂白性,次氯酸才有漂白性.
点评:本题考查了氯气的实验室制法,根据反应物状态及反应条件选取反应装置,其装置顺序为:反应装置→洗气装置→干燥装置→收集装置→尾气处理装置,再结合次氯酸的漂白性分析解答,知道次氯酸漂白原理,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列除杂(括号内为杂质)实验设计能达到预期目的是( )
| A、乙烷(乙烯):KMnO4酸性溶液,洗气 |
| B、乙醇(乙酸):碱石灰,蒸馏 |
| C、甲苯(苯酚):浓溴水,过滤 |
| D、溴乙烷(乙醇):苯,分液 |
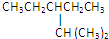
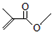 的分子式:
的分子式:
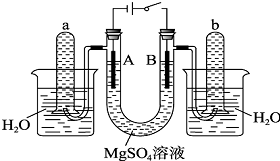 如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色.(指示剂的pH变色范围:6.8~8.0,酸色-红色,碱色-黄色)
如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色.(指示剂的pH变色范围:6.8~8.0,酸色-红色,碱色-黄色)