题目内容
运用物质结构的知识完成下列问题.
(1)第一电离能介于B、N之间的第二周期元素有 (填元素符号).
(2)配离子[TiCl(H2O)5]2+的中心离子化合价为 ,配体的化学式为 .
(3)BF3与一定量水形成(H2O)2?BF3晶体Q,Q在一定条件下可转化为R:
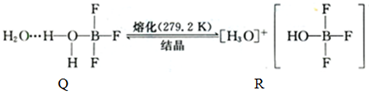
①晶体Q中不存在的作用力为 (填字母).
A.共价键 B.离子键 C.配位键 D.范德华力 E.氢键
②R中阳离子的空间构型为 .
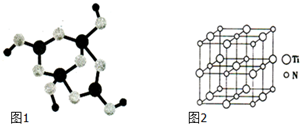
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图1所示.则m= (填数字).
(5)以四氯化钛、碳化钙、叠氮酸盐(如NaN3)作原料,可以生成碳氮化钛化合物,其结构是用碳原子取代氮化钛晶胞(结构如图2)所有顶点的氮原子,这种碳氮化钛化合物的化学式为 .
(6)部分化学键的键能见表:
①比较下列两组物质的熔点高低 (填“>”或“<”)
SiC Si;SiCl4 SiO2
②工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)
Si(s)+4HCl(g)
计算该反应的反应热△H= kJ/mol.
(1)第一电离能介于B、N之间的第二周期元素有
(2)配离子[TiCl(H2O)5]2+的中心离子化合价为
(3)BF3与一定量水形成(H2O)2?BF3晶体Q,Q在一定条件下可转化为R:

①晶体Q中不存在的作用力为
A.共价键 B.离子键 C.配位键 D.范德华力 E.氢键
②R中阳离子的空间构型为
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图1所示.则m=
(5)以四氯化钛、碳化钙、叠氮酸盐(如NaN3)作原料,可以生成碳氮化钛化合物,其结构是用碳原子取代氮化钛晶胞(结构如图2)所有顶点的氮原子,这种碳氮化钛化合物的化学式为

(6)部分化学键的键能见表:
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
SiC
②工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)
| ||
计算该反应的反应热△H=
考点:配合物的成键情况,元素电离能、电负性的含义及应用,判断简单分子或离子的构型,晶胞的计算,反应热和焓变
专题:化学键与晶体结构
分析:(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第ⅡA元素第一电离能大于第ⅢA元素,第ⅤA族的第一电离能大于第ⅥA族元素;
(2)配离子[TiCl(H2O)5]2+中Cl-、H2O含有孤对电子对是配体,根据离子电荷判断中心离子Tin+的电荷;
(3)①非金属元素原子之间易形成共价键,含有空轨道的原子和含有孤电子对的原子之间易形成配位键,分子之间存在范德华力,水分子中的O原子和其它分子中的H原子易形成氢键;②根据价层电子对互斥理论确定H3O+空间构型;
(4)根据化合价代数和为零作判断;
(5)利用均摊法计算该晶胞中含有的各种原子个数,从而确定其化学式;
(6)①物质的熔点与晶体类型有关,原子晶体的熔点大于分子晶体的熔点;如果晶体类型相同,物质的熔点与化学键的键长成反比,键长越短,键能越大,熔点越高;
②化学反应方程式中的反应热=反应物的键能之和-生成物的键能之和;
(2)配离子[TiCl(H2O)5]2+中Cl-、H2O含有孤对电子对是配体,根据离子电荷判断中心离子Tin+的电荷;
(3)①非金属元素原子之间易形成共价键,含有空轨道的原子和含有孤电子对的原子之间易形成配位键,分子之间存在范德华力,水分子中的O原子和其它分子中的H原子易形成氢键;②根据价层电子对互斥理论确定H3O+空间构型;
(4)根据化合价代数和为零作判断;
(5)利用均摊法计算该晶胞中含有的各种原子个数,从而确定其化学式;
(6)①物质的熔点与晶体类型有关,原子晶体的熔点大于分子晶体的熔点;如果晶体类型相同,物质的熔点与化学键的键长成反比,键长越短,键能越大,熔点越高;
②化学反应方程式中的反应热=反应物的键能之和-生成物的键能之和;
解答:
解:(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第ⅡA元素第一电离能大于第ⅢA元素,第ⅤA族的第一电离能大于第ⅥA族元素,所以第二周期中第一电离能顺序为:Li<B<Be<C<O<N,第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素;
故答案为:Be、C、O;
(2)配离子[TiCl(H2O)5]2+的中心离子所带的电荷2+1=3,故中心离子为Ti3+,Cl-、H2O含有孤对电子对是配体,故答案为:+3,Cl-、H2O;
(3)①非金属元素原子之间易形成共价键,B原子含有空轨道、O原子含有孤电子对,所以B原子和O原子之间存在配位键,分子之间存在范德华力,水分子中的O原子和其它分子中的H原子易形成氢键,所以不涉及的是离子键,故选B;
②H3O+中O原子价层电子对个数=3+
(6-1-3×1)=4且含有一个孤电子对,所以为三角锥形结构,故答案为:三角锥形;
(4)依据化合价H为+1,B为+3,O为-2,可得m=2,故答案为:2;
(5)该晶胞中C原子个数=8×
,N原子个数=6×
,Ti原子个数=1+12×
,所以其化学式为:Ti4CN3,故答案为:Ti4CN3;
(6)①碳化硅和硅都是原子晶体,晶体类型相同的物质其熔点与键长成正比,键长越长,键能越小,熔点越低,碳化硅的键长小于硅硅键长,所以碳化硅的熔点比硅的高;二氧化硅是原子晶体,氯化硅是分子晶体,原子晶体的熔点高于分子晶体,所以二氧化硅的熔点比氯化硅的高.
故答案为:>,<;
②△H=360kJ/mol×4+436kJ/mol×2-176kJ/mol×2-431kJ/mol×4=+236 kJ/mol.
故答案为:+236.
故答案为:Be、C、O;
(2)配离子[TiCl(H2O)5]2+的中心离子所带的电荷2+1=3,故中心离子为Ti3+,Cl-、H2O含有孤对电子对是配体,故答案为:+3,Cl-、H2O;
(3)①非金属元素原子之间易形成共价键,B原子含有空轨道、O原子含有孤电子对,所以B原子和O原子之间存在配位键,分子之间存在范德华力,水分子中的O原子和其它分子中的H原子易形成氢键,所以不涉及的是离子键,故选B;
②H3O+中O原子价层电子对个数=3+
| 1 |
| 2 |
(4)依据化合价H为+1,B为+3,O为-2,可得m=2,故答案为:2;
(5)该晶胞中C原子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
(6)①碳化硅和硅都是原子晶体,晶体类型相同的物质其熔点与键长成正比,键长越长,键能越小,熔点越低,碳化硅的键长小于硅硅键长,所以碳化硅的熔点比硅的高;二氧化硅是原子晶体,氯化硅是分子晶体,原子晶体的熔点高于分子晶体,所以二氧化硅的熔点比氯化硅的高.
故答案为:>,<;
②△H=360kJ/mol×4+436kJ/mol×2-176kJ/mol×2-431kJ/mol×4=+236 kJ/mol.
故答案为:+236.
点评:本题考查的知识点较多,有第一电离能、配合物的结构、化学键、晶胞的结构的计算、反应热的计算等,知识跨度较大,中等难度.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
下列物质属于等电子体一组的是( )
| A、CH4和NH4+ |
| B、N2O4和C2H4 |
| C、CO2和NO2 |
| D、H2O和CH4 |
下列说法正确的是( )
| A、常温常压下,8克O3含有0.5NA个氧原子(相对原子质量O:16) |
| B、1mol?L-1的Ca(ClO)2溶液中含ClO-数目为2NA |
| C、标准状况下,22.4L HCl溶于1L水中所得的盐酸含有NA个HCl分子 |
| D、1mol Na被完全氧化生成Na2O2,失去2NA个电子 |
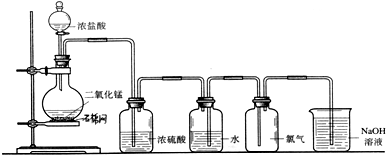
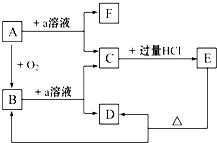 在下列物质的转化关系中,A是一种固体单质,且常作半导体材料,E是一种白色沉淀,F是最轻的气体单质.据此填写:
在下列物质的转化关系中,A是一种固体单质,且常作半导体材料,E是一种白色沉淀,F是最轻的气体单质.据此填写: 、CH3CH2OH中与甲烷互为同系物的是
、CH3CH2OH中与甲烷互为同系物的是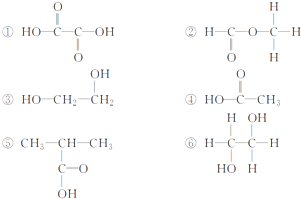
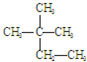 ③白磷 ④18O ⑤
③白磷 ④18O ⑤ ⑥红磷 ⑦16O ⑧氯气.
⑥红磷 ⑦16O ⑧氯气.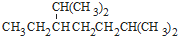 的名称为
的名称为 名称
名称