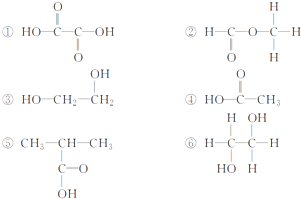
题目内容
在CaCl2、KOH、Na2O2、N2、H2O2、CO2中:
(1)只含有离子键的物质的是 ,只含有极性键的物质为 ,既含有极性键又含有非极性键的物质是 (写化学式).
(2)只含有非极性键的物质的为 ,既含有离子键又含有极性键的物质为 ,既含有离子
键又含有非极性键的物质为 (写电子式).
(1)只含有离子键的物质的是
(2)只含有非极性键的物质的为
键又含有非极性键的物质为
考点:离子化合物的结构特征与性质,共价键的形成及共价键的主要类型,极性键和非极性键
专题:化学键与晶体结构
分析:一般来说,活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键;
含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物.
含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物.
解答:
解:(1)这些物质中只有CaCl2存在离子键,钙离子和氯离子之间存在离子键;
二氧化碳中C原子和O原子之间存在极性键,所以只有CO2存在极性键;
双氧水分子中H原子和O原子之间存在极性键、O原子和O原子之间存在非极性键,只有H2O2存在极性键和非极性键,
故答案为:CaCl2;CO2;H2O2;
(2)单质分子中只存在非极性键,所以氮气分子中存在非极性键;KOH中钾离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性键,所以KOH中存在离子键和极性键;
过氧化钠中钠离子和过氧根离子之间存在离子键、O原子之间存在非极性键,所以过氧化钠中存在离子键和非极性键,
故答案为:N2;KOH;Na2O2.
二氧化碳中C原子和O原子之间存在极性键,所以只有CO2存在极性键;
双氧水分子中H原子和O原子之间存在极性键、O原子和O原子之间存在非极性键,只有H2O2存在极性键和非极性键,
故答案为:CaCl2;CO2;H2O2;
(2)单质分子中只存在非极性键,所以氮气分子中存在非极性键;KOH中钾离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性键,所以KOH中存在离子键和极性键;
过氧化钠中钠离子和过氧根离子之间存在离子键、O原子之间存在非极性键,所以过氧化钠中存在离子键和非极性键,
故答案为:N2;KOH;Na2O2.
点评:本题考查了离子键和共价键的判断,根据微粒之间存在的作用力确定化学键类型,注意离子和共价键的区别,知道电子式的书写,题目难度不大.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
下列各组离子中,能在溶液中大量共存的是( )
| A、Na+ H+ NO3- Fe2+ |
| B、Ca2+ NO3- HCO3- OH- |
| C、K+ H+ Cl- SO42- |
| D、Fe3+ Cl- H+ CO32- |
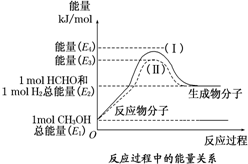 甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备.甲醛与气态甲醇转化的能量关系如图所示.
甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备.甲醛与气态甲醇转化的能量关系如图所示.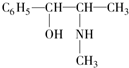
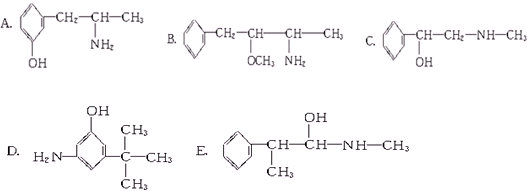
 、CH3CH2OH中与甲烷互为同系物的是
、CH3CH2OH中与甲烷互为同系物的是