题目内容
Ⅰ.CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.
(1)已知:C(s)+O2(g)═CO2(g)△H1═-393.5kJ?mol-1
C(s)+H2O(g)═CO(g)+H2(g)△H2═+131.3kJ?mol-1
则反应CO(g)+H2(g)+O2(g)═H2O(g)+CO2(g)△H═ kJ?mol-1.
(2)利用反应CO(g)+H2(g)+O2(g)═CO2(g)+H2O(g)设计而成的MCFS燃料电池是用水煤气(CO和H2物质的量之比为1:1)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质的一种新型电池.现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置以及现象如上图所示.则有: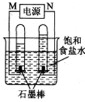
①燃料电池即电源的N极的电极反应式为 ;
②已知饱和食盐水的体积为1L,一段时间后,测得左侧试管中气体体积为11.2mL(标准状况),若电解前后溶液的体积变化忽略不计,而且电解后将溶液混合均匀,则此时溶液的pH为 .
(3)在不同的温度下,将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行如下反应:CO(g)+H2O(g)═CO2(g)+H2(g),得到如下数据:
①实验1中以v(CO2)表示的平均反应速率为 (取2位小数).
②下列措施可能使上述反应中CO的转化率增大的是 (填序号);
A.升高温度 B.降低温度 C.增大压强 D.再加入一定量H2O(g) E.使用催化剂.
(1)已知:C(s)+O2(g)═CO2(g)△H1═-393.5kJ?mol-1
C(s)+H2O(g)═CO(g)+H2(g)△H2═+131.3kJ?mol-1
则反应CO(g)+H2(g)+O2(g)═H2O(g)+CO2(g)△H═
(2)利用反应CO(g)+H2(g)+O2(g)═CO2(g)+H2O(g)设计而成的MCFS燃料电池是用水煤气(CO和H2物质的量之比为1:1)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质的一种新型电池.现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置以及现象如上图所示.则有:

①燃料电池即电源的N极的电极反应式为
②已知饱和食盐水的体积为1L,一段时间后,测得左侧试管中气体体积为11.2mL(标准状况),若电解前后溶液的体积变化忽略不计,而且电解后将溶液混合均匀,则此时溶液的pH为
(3)在不同的温度下,将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行如下反应:CO(g)+H2O(g)═CO2(g)+H2(g),得到如下数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
②下列措施可能使上述反应中CO的转化率增大的是
A.升高温度 B.降低温度 C.增大压强 D.再加入一定量H2O(g) E.使用催化剂.
考点:化学电源新型电池,热化学方程式,反应速率的定量表示方法,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)根据盖斯定律构造出目标反应热化学反应方程式,据此计算反应热;注意化学计量数乘以不同的系数,进行加减,焓变也要乘以相同的系数,做相应加减;
(2)①由图可知:电解饱和食盐水,阴极生成氢气,阳极生成氯气,氯气易溶于水,体积较小,则右端为阳极,所以N为原电池的正极,正极上氧气得电子;
②电解饱和食盐水时,阳极上是氯离子失电子,电极反应为:2Cl--2e-═Cl2↑,阴极上是氢离子得电子,2H++2e-═H2↑,根据氢氧化钠与氢气的关系式计算出溶液中的氢氧根离子、氢离子的浓度,然后计算出溶液的pH;
(3)①由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,根据v=
计算v(CO),再利用速率之比等于化学计量数之比计算v(CO2);
②提高CO的平衡转化率,平衡正向进行,结合平衡移动原理分析判断.
(2)①由图可知:电解饱和食盐水,阴极生成氢气,阳极生成氯气,氯气易溶于水,体积较小,则右端为阳极,所以N为原电池的正极,正极上氧气得电子;
②电解饱和食盐水时,阳极上是氯离子失电子,电极反应为:2Cl--2e-═Cl2↑,阴极上是氢离子得电子,2H++2e-═H2↑,根据氢氧化钠与氢气的关系式计算出溶液中的氢氧根离子、氢离子的浓度,然后计算出溶液的pH;
(3)①由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,根据v=
| ||
| △t |
②提高CO的平衡转化率,平衡正向进行,结合平衡移动原理分析判断.
解答:
解:Ⅰ.(1)已知:①C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol,
②C(s)+H2O(g)=CO(g)+H2(g)△H2=+131.3kJ/mol,
根据盖斯定律,①-②得CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g),△H=-393.5-131.3=-524.8kJ/mol,
故答案为:-524.8;
(2)①由图可知:电解饱和食盐水,阴极生成氢气,阳极生成氯气,氯气易溶于水,体积较小,则右端为阳极,所以N为原电池的正极,正极上氧气得电子和二氧化碳反应生成碳酸根离子而发生还原反应,电极反应式为:O2+4e-+2CO2=2CO32-,
故答案为:O2+4e-+2CO2=2CO32-;
②电极饱和食盐水,阴极发生了反应:2H++2e-═H2↑,由2NaOH~H2↑,阴极得到11.2mL标准状况下的气体,则n(OH-)=
×2=0.001mol,
溶液中c(OH-)=
=0.001mol/L,c(H+)=
mol/L=1×10-11mol/L,
所以pH=11,
故答案为:11;
(3)①、由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,v(CO)=
=
mol/(L?min),速率之比等于化学计量数之比,
故v(CO2)=v(CO)=
mol/(L?min)=0.13mol/(L?min),
故答案为:0.13mol/(L?min);
②CO(g)+H2O(g)?CO2(g)+H2 (g),反应是气体体积不变的放热反应;
A.反应是放热反应,升高温度平衡逆向进行,一氧化碳转化率减小,故A不符合;
B.反应是放热反应,降低温度,平衡向正方向移动,一氧化碳转化率增大,故B符合;
C.反应前后气体体积不变,增大压强平衡不动,一氧化碳转化率不变,故C不符合;
D.再加入一定量H2O(g),平衡正向进行,一氧化碳转化率增大,故D符合;
E.使用催化剂平衡不移动,所以一氧化碳转化率不变,故E不符合;
故答案为:BD.
②C(s)+H2O(g)=CO(g)+H2(g)△H2=+131.3kJ/mol,
根据盖斯定律,①-②得CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g),△H=-393.5-131.3=-524.8kJ/mol,
故答案为:-524.8;
(2)①由图可知:电解饱和食盐水,阴极生成氢气,阳极生成氯气,氯气易溶于水,体积较小,则右端为阳极,所以N为原电池的正极,正极上氧气得电子和二氧化碳反应生成碳酸根离子而发生还原反应,电极反应式为:O2+4e-+2CO2=2CO32-,
故答案为:O2+4e-+2CO2=2CO32-;
②电极饱和食盐水,阴极发生了反应:2H++2e-═H2↑,由2NaOH~H2↑,阴极得到11.2mL标准状况下的气体,则n(OH-)=
| 0.0112L |
| 22.4L/mol |
溶液中c(OH-)=
| 0.001mol |
| 1L |
| 1×10-14 |
| 0.001 |
所以pH=11,
故答案为:11;
(3)①、由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,v(CO)=
| ||
| 6min |
| 2 |
| 15 |
故v(CO2)=v(CO)=
| 2 |
| 15 |
故答案为:0.13mol/(L?min);
②CO(g)+H2O(g)?CO2(g)+H2 (g),反应是气体体积不变的放热反应;
A.反应是放热反应,升高温度平衡逆向进行,一氧化碳转化率减小,故A不符合;
B.反应是放热反应,降低温度,平衡向正方向移动,一氧化碳转化率增大,故B符合;
C.反应前后气体体积不变,增大压强平衡不动,一氧化碳转化率不变,故C不符合;
D.再加入一定量H2O(g),平衡正向进行,一氧化碳转化率增大,故D符合;
E.使用催化剂平衡不移动,所以一氧化碳转化率不变,故E不符合;
故答案为:BD.
点评:本题考查了盖斯定律的应用、原电池原理和电解池原理的应用、反应速率的计算和影响平衡的因素等,题目综合性强,难道较大,侧重于考查学生对基础知识的综合应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列反应中,水既不是氧化剂,也不是还原剂,但反应是氧化还原反应的是( )
| A、2Na2O2+2H2O═4NaOH+O2↑ | ||||
B、C+H2O
| ||||
| C、CO2+NH3+H2O═NH4HCO3 | ||||
| D、2F2+2H2O═4HF+O2 |
 在下列物质的转化关系中,A是一种固体单质,且常作半导体材料,E是一种白色沉淀,F是最轻的气体单质.据此填写:
在下列物质的转化关系中,A是一种固体单质,且常作半导体材料,E是一种白色沉淀,F是最轻的气体单质.据此填写: ③白磷 ④18O ⑤
③白磷 ④18O ⑤ ⑥红磷 ⑦16O ⑧氯气.
⑥红磷 ⑦16O ⑧氯气.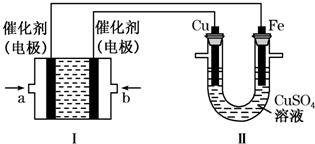 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题: