题目内容
【题目】下列对于硝酸的认识正确的是( )
A.稀硝酸能使红色石蕊试纸变蓝
B.硝酸能与碳酸钠反应,但不能生成二氧化碳
C.硝酸能与金属反应放出氢气
D.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
【答案】D
【解析】
A. 稀硝酸不能使红色石蕊试纸变蓝,硝酸具有强氧化性,有漂白作用,故A错误;
B. 硝酸具有酸性,能与碳酸钠反应放出二氧化碳气体,故B正确;
C. 硝酸具有强氧化性,不能与金属发生置换反应产生氢气,通常反应生成NO或NO2气体,故C错误;
D. 浓硝酸在光照下颜色变黄,其原因是硝酸分解生成二氧化氮溶于硝酸中,说明浓硝酸不稳定,故D错误;
故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】锰是一种非常重要的金属元素,在很多领域有着广泛的应用。利用废铁屑还原浸出低品位软锰矿制备硫酸锰,然后进行电解,是制备金属锰的新工艺,其流程简图如下:
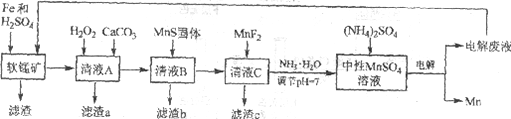
已知:
i. 低品位软锰矿主要成份有MnO2、Al2O3、Fe2O3、Cu2(OH)2CO3、CaCO3、SiO2等。
ii. 部分金属离子以氢氧化物沉淀时的pH
Fe2+ | Fe3+ | Al3+ | Mn2+ | Cu2+ | |
开始沉淀的pH | 6.8 | 1.8 | 3.7 | 8.6 | 5.2 |
沉淀完全的pH | 8.3 | 2.8 | 4.7 | 10.1 | 6.7 |
iii. 几种化合物的溶解性或溶度积(Ksp)
MnF2 | CaS | MnS | FeS | CuS |
溶于水 | 溶于水 | 2.5×10-13 | 6.3×10-18 | 6.3×10-36 |
(1)研究表明,单质Fe和Fe2+都可以还原MnO2。在硫酸存在的条件下,MnO2将Fe氧化为span>Fe3+的离子方程式是____________。
(2)清液A先用H2O2处理,然后加入CaCO3,反应后溶液的pH≈5。滤渣a的主要成分中有黄铵铁矾NH4Fe3(SO4)2(OH)6。
①H2O2的作用是____________(用离子方程式表示)。
②滤渣a中除了黄铵铁矾,主要成分还有X。用平衡移动原理解释产生x的原因:____________。
(3)用离子方程式表示MnS固体的作用:____________。
(4)滤渣c的成分是____________。
(5)如下图所示装置,用惰性电极电解中性MnSO4溶液可以制得金属Mn。阴极反应有:
i. Mn2++2e-=Mn ii. 2H++2e-=H2↑
电极上H2的产生会引起锰起壳开裂,影响产品质量。
①电解池阳极的电极方程式是________________。
②清液C需要用氨水调节pH=7的原因是____________。
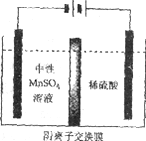
③电解时,中性MnSO4溶液中加入(NH4)2SO4的作用除了增大溶液导电性之外,还有___________(结合电极反应式和离子方程式解释)。