��Ŀ����
����Ŀ����������Դ�ǽ��������Ⱦ����Ч;��֮һ��ȼ�ϵ����������ת���ʸߣ�����Ϊ������Դ�����Ʒ��Խ��Խ�ܵ���ע��
(1)ֱ�Ӽ״�ȼ�ϵ��(���DMFC)�ṹ���Ի�������Ⱦ���乤��ԭ����ͼ��ʾ��
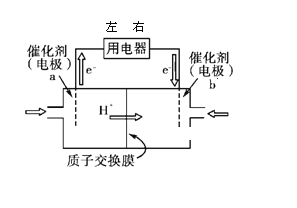
�� ���·���Ӵ��õ���_____(����������������Ҷ���)���ˣ�b ���缫��ӦʽΪ______��
�� ��1.5mol����ͨ���õ����������ĵļ״�����Ϊ______��
(2)һ����������DZͧ��Һ��-Һ��ȼ�ϵ�ص�ԭ����ͼ��ʾ��
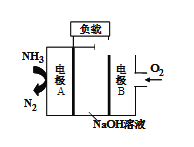
�ٵ缫B����_______(������������ ����ԭ��)��Ӧ����ع���ʱ��OH-����_____(����A��������B����)��
�ڵ缫A�ĵ缫��ӦʽΪ____________��
(3)��ͭ��ijɷ���Cu2O����ͭ��ijɷ���Cu2S������ͭ�����ͭ���ϼ��������·�Ӧ��2Cu2O+Cu2S == 6Cu+SO2���ڸ÷�Ӧ�У��������ǣ�___________ ��ԭ������___________ ÿ����0.3mol����ͨ��ʱ�����ɵ�ͭ�����ʵ���Ϊ ___________mol ���ɵ�SO2 �ڱ���µ����Ϊ_________ L
���𰸡���� O2+4e-+4H+=2H2O 8g ��ԭ A�� 2NH3+6OH--6e-=N2��+6H2O Cu2S��Cu2O Cu2S 0.3 11.2
��������
��1������ͼ֪������Ĥ�����ӽ���Ĥ����������Һ�����ԣ������������ƶ�����֪��ͨ��a�ĵ缫Ϊ������ͨ��b�ĵ缫Ϊ�����������������õ��ӷ�����ԭ��Ӧ��
��2�����ݵ�صĹ���ԭ��ʾ��ͼ֪����ͨ�������ĵ缫B���������缫A�Ǹ�����
��3����ӦCu2S+2Cu2O�T6Cu+SO2���У����ϼ۽��͵�Ԫ����Cu�����ϼ����ߵ�Ԫ����S��ÿ����1molCu����ԭ��ת�Ƹ��������ĵ���Ϊ1mol���ݴ˴��⡣
��1���ٸ���ͼ֪������Ĥ�����ӽ���Ĥ����������Һ�����ԣ������������ƶ�����֪��ͨ��a�ĵ缫Ϊ������ͨ��b�ĵ缫Ϊ�����������������õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪO2+4e-+4H+=2H2O��
�ʴ�Ϊ����ˣ�O2+4e-+4H+=2H2O��
�ڸ����ϼ״�ʧȥ���ӷ���������Ӧ��������ӦʽΪCH3OH-6e-+H2O=CO2+6H+���ɵ缫����ʽ��֪��ÿ����1mol�ļ״���ת��6mol�ĵ��ӣ�����1.5mol����ͨ���õ���ʱ�������ĵļ״������ʵ���Ϊ0.25mol������Ϊ0.25mol��32g/mol=8g���ʴ�Ϊ��8g��
��2������ȼ�ϵ�ص����������������õ��ӵĻ�ԭ��Ӧ�����Ե缫BΪ����������ԭ��Ӧ����ع���ʱ��OH�����ƶ����ʴ�Ϊ����ԭ��A����
����ȼ�ϵ�صĸ����Ϸ���ȼ�ϰ���ʧ���ӵ�������Ӧ������Ի����µ缫A�����ĵ缫��ӦΪ��2NH3+6OH--6e-=N2��+6H2O���ʴ�Ϊ��2NH3+6OH--6e-=N2��+6H2O��
��3����ӦCu2S+2Cu2O�T6Cu+SO2���У����ϼ۽��͵�Ԫ����Cu�����ڵķ�Ӧ��Cu2S��Cu2O�������������ϼ����ߵ�Ԫ����S�����ڵķ�Ӧ��Cu2S�ǻ�ԭ�����ɷ�Ӧ����ʽ��֪��ÿ����1molCu����ԭ��ת�Ƹ��������ĵ���Ϊ1mol�����Ե���0.3mol����ͨ��ʱ�����ɵ�ͭ�����ʵ���Ϊ0.3mol�����ɵ�SO2�����ʵ���Ϊ0.5mol���ڱ���µ����Ϊ0.5mol��22.4L/mol=11.2L���ʴ�Ϊ��Cu2S��Cu2O��Cu2S��0.3��11.2��

 �������ͬ����ϰϵ�д�
�������ͬ����ϰϵ�д�