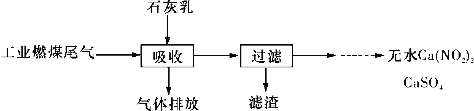
题目内容
【题目】下列离子方程式书写正确的是( )
A. Na与水反应Na+H2O===Na++OH-+H2↑
B. 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
C. 实验室盛装NaOH溶液的试剂瓶不能用玻璃塞SiO2+2OH-==SiO32-+H2O
D. 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++OH-+HCO3-==CaCO3↓+H2O+CO32-
【答案】C
【解析】
A.原子个数不守恒;
B.氢氧化铁胶体不是沉淀,不能用沉淀符号;
C.二氧化硅为酸性氧化物,能够与氢氧化钠反应生成硅酸钠溶液,硅酸钠具有粘性;
D.氢氧化钠过量,反应生成碳酸钙、碳酸钠和水;
A.Na与水反应生成氢氧化钠和氢气,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,故B错
Fe(OH)3(胶体)+3H+,故B错
C.二氧化硅为酸性氧化物,能够与氢氧化钠反应生成硅酸钠溶液,离子方程式:SiO2+2OH-═SiO32-+H2O,故C正确;
D.向碳酸氢钙溶液中加入过量的氢氧化钠溶液反应生成碳酸钙、碳酸钠和水,离子方程式:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32-,故D错误;
正确选项C。

【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于下图所示的装置中进行中和热的测定实验,回答下列问题:

(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是___________________________________。
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于_________。
(3)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量_______(填“相等”“不相等”),若实验操作均正确,则所求中和热__________(填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:________。(从下列选出)
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)实验数据如下表:①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ___________ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | ||
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=_________。(提示:ΔH=-![]() ,保留一位小数)。
,保留一位小数)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(6)如果用含0.5mol Ba(OH)2的稀溶液与足量稀硫酸溶液反应,反应放出的热____57.3 kJ(填“大于”、“小于”或“等于”)。