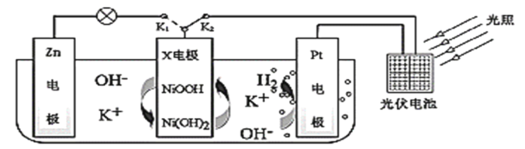
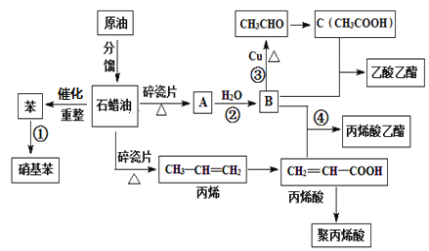
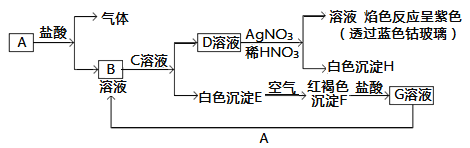
题目内容
【题目】以磷石膏(主要成分是CaSO4,含少量的Al2O3、SiO2等杂质)为原料制备Na2SO4、CaBr2·2H2O和NH4Cl等产品的工艺流程如下:
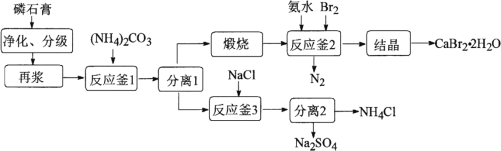
请回答:
(1) 反应釜1中![]() 的浸出率与加料速度、反应温度的关系如下图所示:
的浸出率与加料速度、反应温度的关系如下图所示:
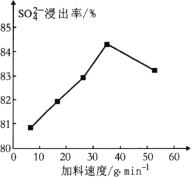
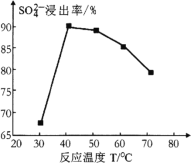
①反应的最佳条件为________。
②其它条件相同时,![]() 浸出率随反应温度先升后降的原因是________。
浸出率随反应温度先升后降的原因是________。
(2) 实验室里模拟上述煅烧操作,下列仪器中有用到的是________。
A 瓷坩埚 B 铁坩埚
C 酒精灯 D 酒精喷灯
(3) 反应釜2中进行的反应是________。
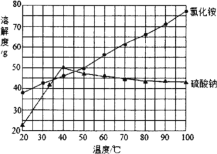
(4) 反应釜3中完成反应后,分离硫酸钠、氯化铵的操作:在90℃左右蒸发浓缩至较多晶体析出→________得到Na2SO4粗品;同时,将热滤液________→得NH4Cl粗品(Na2SO4、NH4Cl的溶解度如图所示)。
【答案】加料速度为36 g·min1、反应温度为40℃ (温度低于40℃反应速率慢)温度在30~40℃时,温度越高反应速率越快;高于40℃(NH4)2CO3受热分解 BD 3CaO+2NH3·H2O+3Br2=3CaBr2+N2+5H2O或3CaO+2NH3+3Br2=3CaBr2+N2+3H2O 趁热过滤 冷却至35℃左右、趁热过滤或冷却至35~40℃过滤
【解析】
(1)根据图象找出硫酸根离子浸出率最高的加料速度和温度;
(2)根据温度对反应速率的影响和温度对碳酸铵的影响分析;
(3)根据煅烧碳酸钙时不能与容器反应分析使用的容器,根据煅烧的温度选择加热仪器。
(4)根据已给反应物分析反应产物,根据元素化合价变化分析。
(5)物质的溶解度变化曲线分析分离提纯的方法。
(1) ①从图分析,加料速度为36 g·min1、反应温度为40℃时硫酸根离子浸出率最高,为最佳条件;
②反应釜1中加入碳酸铵,随着温度升高,(温度低于40℃反应速率慢)温度在30~40℃时,反应速率越快硫酸根离子浸出率升高;高于40℃(NH4)2CO3受热分解,硫酸根离子的浸出率降低;
(2)因为是煅烧碳酸钙,其与瓷坩埚中的二氧化硅反应,所以选择铁坩埚,煅烧需要较高的温度,选择酒精喷灯,故选BD;
(3).碳酸钙煅烧后生成氧化钙和二氧化碳,加入氨水和溴反应生成溴化钙,因为溴元素化合价降低,所以有氮元素化合价升高生成氮气,方程式为: 3CaO+2NH3·H2O+3Br2=3CaBr2+N2+5H2O或3CaO+2NH3+3Br2=3CaBr2+N2+3H2O;
(4)根据氯化铵和硫酸钠的溶解度曲线分析,随着温度升高,硫酸钠的溶解度降低,而氯化铵的溶解度升高,所以在在90℃左右蒸发浓缩至较多晶体析出趁热过滤得到硫酸钠晶体,滤液冷却至35℃左右、趁热过滤或冷却至35~40℃过滤可得到氯化铵晶体。