题目内容
【题目】氮和硫的氧化物的综合利用是目前研究的热点之一。已知:
i.N2(g)+O2(g)=2NO(g) △H=+180.0 kJ·mol-1
ii.2SO2(g)+O2(g)=2SO3(g) △H=-196.6 kJ·mol-1
iii.2NO(g)+O2(g)=2NO2(g) △H=-113.0 kJ·mol-1
(1)反应iV:2NO2(g)+2SO2(g)=2SO3(g)+N2(g)+O2(g)的 △H=________;该反应在密闭容器中达到平衡后,只改变下列条件,一定能使N2的平衡体积分数增大的是______(填选项字母)。
A 缩小容器容积 B 再充入SO2 C 降低温度 D 分离出SO3
(2)T1°C时,容积相等的密闭容器中分别充入NO2和SO2的混合气体4 mol,发生反应iV。NO2或SO2的平衡转化率(a)与起始充入的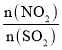 关系如图1所示。
关系如图1所示。
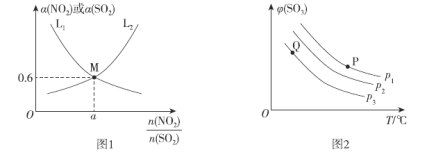
①图中能表示平衡时a(SO2)与起始充入的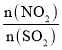 关系的曲线为_____(填“L1”或“L2”)。
关系的曲线为_____(填“L1”或“L2”)。
②反应的平衡常数K=________。
(3)向密闭容器中充入一定量SO2和O2,发生反应ii。SO3的平衡体积分数(φ)与温度(T)和压强(p)的关系如图2所示。
①P1、P2 、P3由大到小的顺序为__________。
②P、Q两点对应状态下,单位体积内反应物活化分子数目:P__________Q(填“>”、“<”或“=”)。
【答案】-263.6kJmol-1 CD L2 ![]() p1>p2>p3 >
p1>p2>p3 >
【解析】
(1)根据盖斯定律计算;使N2的平衡体积分数增大,即使平衡正向移动,据此分析;
(2)①假设NO2的量不变,根据SO2的量与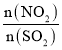 关系的变化结合图像分析;
关系的变化结合图像分析;
②结合图示数据,列三段式计算平衡常数K;
(3)向密闭容器中充入一定量SO2和O2,发生反应ii。SO3的平衡体积分数(φ)与温度(T)和压强(p)的关系如图2所示。
①反应ii.2SO2(g)+O2(g)=2SO3(g)为气体分子数减小的反应,增大压强,平衡正向移动,SO3的体积分数增大,据此分析p1、p2 、p3的大到小的顺序;
②P、Q两点对应状态下温度高低对活化分子数的影响分析。
(1) 已知:i.N2(g)+O2(g)=2NO(g) △H=+180.0 kJ·mol-1
ii.2SO2(g)+O2(g)=2SO3(g) △H=-196.6 kJ·mol-1
iii.2NO(g)+O2(g)=2NO2(g) △H=-113.0 kJ·mol-1
根据盖斯定律,ii- iii- i=iv,则反应iv:2NO2(g)+2SO2(g)=2SO3(g)+N2(g)+O2(g)的 △H=-263.6 kJ·mol-1;该反应2NO2(g)+2SO2(g)=2SO3(g)+N2(g)+O2(g) △H<0,正反应为气体体积增大的体系,在密闭容器中达到平衡后,只改变下列条件,平衡向正反应移动,能使N2的平衡体积分数增大,
A.缩小容器容积,相当于增大压强,平衡逆向移动,N2的平衡体积分数减小,故A不符合题意;
B.再充入SO2,反应物SO2的浓度增大,能使平衡正向移动,若无限充入SO2,N2的平衡体积分数可能会减小,故B不符合题意;
C.降低温度,反应向放热的方向移动,即向正向移动,N2的平衡体积分数增大,故C符合题意;
D.分离出SO3,生成物的浓度减小,平衡正向移动,N2的平衡体积分数增大,故D符合题意;
答案选CD;
(2)①设SO2的量不变,向体系中加入NO2,反应正向移动,SO2的转化率增大,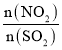 的比值增大,结合图像分析可得,L2代表a(SO2),L1代表a(NO2);
的比值增大,结合图像分析可得,L2代表a(SO2),L1代表a(NO2);
②根据图像所示,M点时,SO2和NO2的转化率相等,都为0.6,根据反应2NO2(g)+2SO2(g)2SO3(g)+N2(g)+O2(g)可知,SO2和NO2的初始量分别为2mol,设容器的体积为1L,列三段式:

反应的平衡常数K=![]() =
=![]() ;
;
(3)①反应ii.2SO2(g)+O2(g)=2SO3(g)为气体分子数减小的反应,增大压强,平衡正向移动,SO3的体积分数增大,结合图像可得p1>p2>p3;
②根据图2所示,P、Q两点对应的温度不同,且P点温度高于Q点温度,温度越高,单位体积内反应物活化分子数目越多,则P、Q两点反应物活化分子数目P>Q。

 阅读快车系列答案
阅读快车系列答案【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上电子数是K层上电子数的3倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X位于元素周期表的第____周期第__族,它的一种核素可测定文物年代,这种核素的符号是____。
(2)元素Y的原子结构示意图为___,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法_____。
(3)元素Z与元素T相比,非金属性较强的是___(用元素符号表示),下列表述中能证明这一事实的是___。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是____,理由______。
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作 | 结论 |
A | 向甲苯中滴加少量高锰酸钾溶液,高锰酸钾溶液褪色 | 甲苯发生了氧化反应 |
B | 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液,有沉淀生成 | 蛋白质发生了变性 |
C | 向某溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀 | 该溶液中含有 |
D | 向淀粉溶液中加入稀硫酸,加热几分钟,冷却后再加入新制的Cu(OH)2悬浊液,加热,没有观察到砖红色沉淀 | 淀粉没有水解 |
A.AB.BC.CD.D