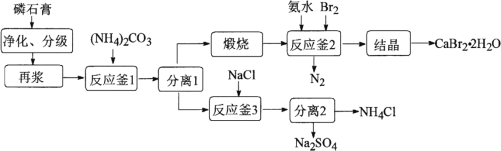
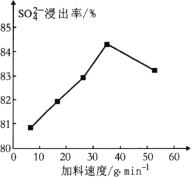
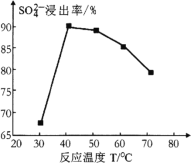
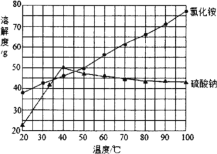
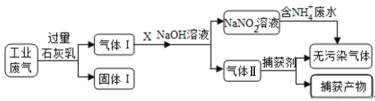
题目内容
【题目】下列离子方程式正确的是
A.NaHSO3溶液中的水解方程式:HSO3+H2O=H3O++![]()
B.FeI2溶液中加双氧水,出现红褐色沉淀:6Fe2++3H2O2=2Fe(OH)3↓+4Fe3+
C.10 mL 0.1 mol·L1 NaOH溶液中滴加几滴AlCl3溶液:Al3++3OH=Al(OH)3↓
D.3a mol CO2通入含2a mol Ba(OH)2的溶液中:3CO2+4OH+Ba2+=BaCO3↓+2![]() +H2O
+H2O
【答案】D
【解析】
A. HSO3+H2O=H3O++![]() 为HSO3的电离方程式,故错误;
为HSO3的电离方程式,故错误;
B. FeI2溶液中加双氧水,应是碘离子被氧化,生成碘单质,再亚铁离子反应生成铁离子,故错误;
C. 10 mL 0.1 mol·L1 NaOH溶液中滴加几滴AlCl3溶液,说明碱过量,反应生成偏铝酸钠,不是氢氧化铝,故错误;
D. 3a mol CO2通入含2a mol Ba(OH)2的溶液中,反应生成碳酸钡和碳酸氢钡,离子方程式3CO2+4OH+Ba2+=BaCO3↓+2![]() +H2O,故正确;
+H2O,故正确;
故选D。

【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%