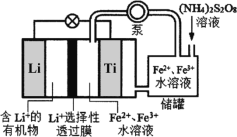
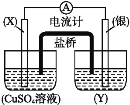
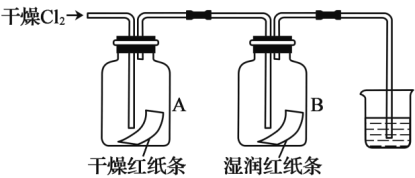
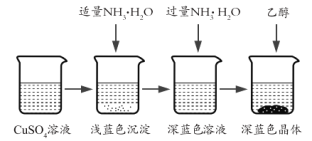
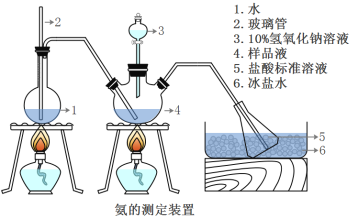
题目内容
【题目】下列对有关微粒结构的表示或说法不正确的是( )
A.氮分子的电子式为::N:::N:
B.氨分子的空间构型为三角锥型,属于极性分子
C.白磷属于分子晶体,空间构型为正四面体,键角60°,是非极性分子
D.NH4+离子中的四个N—H键虽然形成方式不同,但键能、键长、键角都相同
【答案】A
【解析】
A.氮气分子中两个氮原子之间以三键结合,每个氮原子各提供三个电子,三对共用电子对应该纵向排列,A项错误;
B.氨分子中氮原子有一对孤电子,因此空间构型为三角锥形,因偶极矩不重合而为极性分子,B项正确;
C.根据磷的原子结构,每个磷要形成3个共价键,因此4个磷原子刚好形成一个正四面体,键角为60°,是非极性分子,C项正确;
D.四个![]() 键中虽然有一个配位键和三个共价键,但是配位键也属于共价键,因此键能、键长和键角都相同,D项正确;
键中虽然有一个配位键和三个共价键,但是配位键也属于共价键,因此键能、键长和键角都相同,D项正确;
答案选A。

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目