题目内容
【题目】向V mL 0.1 mol/L氨水中滴加等物质的量浓度的稀H2SO4,测得混合溶液的温度和pOH [pOH=-lgc(OH-)]随着加入稀硫酸的体积的变化如图所示(实线为温度变化,虚线为pOH变化),下列说法不正确的是
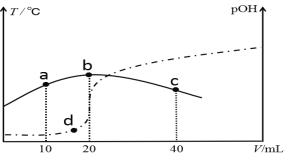
A. V =40
B. b点时溶液的pOH > pH
C. a、b、c三点由水电离的c(H+)依次减小
D. a、b、d三点对应NH3·H2O的电离常数:K(b)>K(d)>K(a)
【答案】C
【解析】
A. b点时溶液温度最高,表明此时酸碱恰好反应完全,因1 mol H2SO4可与2 mol NH3·H2O反应,故x=40,A项正确;
B. b点时恰好反应时生成(NH4)2SO4,溶液显酸性,pOH > pH,B项正确;
C. a点时溶液中的溶质为(NH4)2SO4与NH3·H2O,b点时恰好反应时生成(NH4)2SO4,c点时溶液中的溶质为等物质的量的(NH4)2SO4与H2SO4,由于酸和碱都抑制水的电离,NH4+能促进水的电离,则a、b、c三点中,b点水电离的c(H+)最大,故C错误;
D.a、b、d三点的温度高低顺序为b>d>a,温度越高,NH3·H2O的电离常数越大,D项正确。
故选C。

练习册系列答案
相关题目
【题目】可逆反应2A(g)+B(g) ![]() 2C(g),根据下表中的数据判断下列图像错误的是
2C(g),根据下表中的数据判断下列图像错误的是
压强 A的转化率 温度 | P1(MPa) | P2(MPa) |
400℃ | 99.6% | 99.7% |
500℃ | 96.9% | 97.8% |
A.  B.
B.  C.
C.  D.
D.