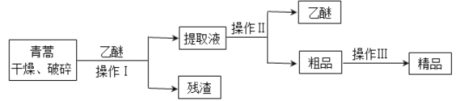
题目内容
【题目】工业上常用PCl5作为制造乙酰纤维素的催化剂,也常用于手性药品的研发,在材料,医药工业得到了广泛应用,请回答下列问题:
(1)PCl5在固态是离子化合物,相对式量为417,其阳离子为![]() ,则阴离子的化学式为_______。
,则阴离子的化学式为_______。
(2)已知: P(s) + ![]() Cl2(g) = PCl3(g) H= -306 KJ/mol
Cl2(g) = PCl3(g) H= -306 KJ/mol
PCl5(g) = PCl3(g) + Cl2(g) H= + 93 KJ/mol
则反应2P(s) + 5Cl2(g) = 2PCl5(g)的H=______kJ/mol。
(3)温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,容器中发生反应:PCl5(g)PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
t/min | 0 | 10 | 20 | 30 | 40 |
n(PCl3)/mol | 0 | 0.12 | 0.17 | 0.2 | 0.2 |
①反应在前10min的平均速率v(PCl5)=_______;
②不能表明该反应达到平衡状态的是:____ (选填序号);
a.容器的总压强不再改变
b.混合气体的平均相对分子质量不变
c.v正(PCl3)等于v逆(Cl2)
d.混合气体的密度不变
e.PCl5的质量不再变化
③要提高上述反应的转化率,可采取的措施有(至少两种)___________;
④该温度下,反应PCl5(g)PCl3(g) + Cl2(g)的平衡常数Kp=2.25×105(Kp为压强平衡常数,Kp=![]() )。把一定量的PCl5引入一真空瓶内,达平衡后PCl5的分压为2.5×104Pa,则PCl5的分解率为________。
)。把一定量的PCl5引入一真空瓶内,达平衡后PCl5的分压为2.5×104Pa,则PCl5的分解率为________。
(4)在热水中,五氯化磷完全水解,生成磷酸和盐酸。若将0.01molPCl5投入热水中配成lL溶液,再逐滴加入AgNO3溶液,先产生的沉淀是_____。 [已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10]。
【答案】![]() -798 0.006mol·L-1·min-1 d 可以升高温度,减小压强,移走氯气、三氯化磷等 75% AgCl
-798 0.006mol·L-1·min-1 d 可以升高温度,减小压强,移走氯气、三氯化磷等 75% AgCl
【解析】
计算PCl5固体中阴离子的化学式时,可利用相对分子质量确定分子式,再减去阳离子的化学式;利用盖斯定律,可计算待求热化学反应的H;计算反应在前10min的平均速率v(PCl5)时,可先求出v(PCl3),然后利用化学计量数进行转换;判断某量不变是否为平衡状态时,需判断该量是否为变量,变量不变是平衡状态;提高转化率的措施可以是改变温度、压强、浓度等;求PCl5分解率时,可假设起始量与变化量,建立三段式,利用压强平衡常数先求出
PCl3的平衡量,再求出变化量,最后求转化率;判断先生成的沉淀为Ag3PO4还是AgCl时,可利用Ksp求出两种平衡体系中的c(Ag+),数值小的先生成沉淀。
(1)PCl5的相对分子质量为208.5,则相对式量为417时的化学式为P2Cl10;其阳离子为![]() ,则阴离子的化学式为P2Cl10-
,则阴离子的化学式为P2Cl10-![]() =
=![]() 。答案为:
。答案为:![]() ;
;
(2) P(s) + ![]() Cl2(g) = PCl3(g) H= -306 KJ/mol ①
Cl2(g) = PCl3(g) H= -306 KJ/mol ①
PCl5(g) = PCl3(g) + Cl2(g) H= + 93 KJ/mol ②
利用盖斯定律,将(①-②)×2,便可得出反应2P(s) + 5Cl2(g) = 2PCl5(g)的H=-(306+93)×2kJ/mol= -798 kJ/mol。答案为:-798;
(3)①反应在前10min的平均速率v(PCl5)= v(PCl3)= = 0.006mol·L-1·min-1;
= 0.006mol·L-1·min-1;
②a.因为反应前后气体的分子数不等,所以容器的总压强不再改变时,反应达平衡状态,a不合题意;
b.因为反应前后气体的分子数不等,平衡前混合气体的平衡相对分子质量始终发生改变,所以当混合气体的平均相对分子质量不变时,反应达平衡状态,b不合题意;
c.v正(PCl3)等于v逆(Cl2),满足反应进行方向相反,速率之比等于化学计量数之比,所以反应达平衡状态,c不合题意;
d.因为混合气体的总质量不变,体积不变,所以混合气体的密度始终不变,混合气体密度不变时,反应不一定达平衡状态,d符合题意;
e.只要平衡发生移动,PCl5的质量就发生改变,所以当PCl5的质量不变时,反应达平衡状态,e不合题意;
故选d;
③因为反应为吸热的、分子数增大的可逆反应,所以要提高上述反应的转化率,可采取的措施有:可以升高温度,减小压强,移走氯气、三氯化磷等;
④设PCl5(g)的起始投入量为1mol,参加反应的物质的量为x,其三段式为:
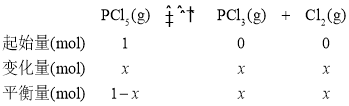
Kp=![]() =2.25×105,p(PCl3)=7.5×104,
=2.25×105,p(PCl3)=7.5×104,![]() ,x=0.75mol,则PCl5的分解率为
,x=0.75mol,则PCl5的分解率为![]() =75%。
=75%。
答案为:0.006mol·L-1·min-1;d;可以升高温度,减小压强,移走氯气、三氯化磷等;75%。
(4)若将0.01molPCl5投入热水中配成lL溶液,则溶液中c(Cl-)=0.05mol/L,c(H3PO4)=0.01mol/L,c(![]() )<0.01mol/L,当Cl-沉淀时,所需c(Ag+)=
)<0.01mol/L,当Cl-沉淀时,所需c(Ag+)=![]() mol/L=3.6×10-9mol/L;当
mol/L=3.6×10-9mol/L;当![]() 生成沉淀时,所需c(Ag+)=
生成沉淀时,所需c(Ag+)=![]() mol/L>1.1×10-6mol/L。因为1.1×10-6>3.6×10-9,所以先产生的沉淀是AgCl。答案为:AgCl。
mol/L>1.1×10-6mol/L。因为1.1×10-6>3.6×10-9,所以先产生的沉淀是AgCl。答案为:AgCl。

 阅读快车系列答案
阅读快车系列答案【题目】动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
实验步骤 | 实验现象 |
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体 |
⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究____________元素性质递变规律。
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等。仪器:①__________,②__________,试管,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应实验现象的编号和②的化学方程式及此实验的结论)__________
实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
实验现象(填A~F) |
①_____________________________________,
②_____________________________________,
此实验的结论:_______________________________________________________。