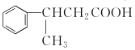题目内容
【题目】硫脲(![]() )是一种白色而有光泽的晶体,味苦,可用于制造树脂,也用作橡胶的硫化促进剂以及金属矿物的浮选剂等。回答下列问题:
)是一种白色而有光泽的晶体,味苦,可用于制造树脂,也用作橡胶的硫化促进剂以及金属矿物的浮选剂等。回答下列问题:
(1)硫脲中硫的化合价为_______;与硫脲互为同分异构且能与FeCl3溶液发生显色反应的化合物的化学式为_______
(2)可用H2NCN(氨基腈)与C2H5SH (乙硫醇)反应制备硫脲。氨基腈的电子式为_____
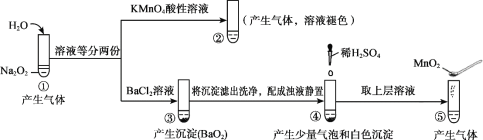
(3)制取氨基腈的传统工艺流程如下:
①反应Ⅱ的化学方程式为______
②测定硫脲含量的方法如下:
步骤1 :准确称取a g产品,经溶解等步骤最后在500 mL容量瓶中定容。
步骤2:准确量取20.00 mL配制好的溶液注入碘量瓶中,加入V1 mL c1 mol/L I2的标
准溶液及适量的NaOH溶液,于暗处放置10 min(2NaOH+I2=NaIO+NaI+H2O,
4NaIO+(NH2)2CS+H2O =(NH2)2CO+4NaI+H2SO2)。
步骤3:加水及适量的盐酸,摇匀。
步骤4:用c2 mol/L标准Na2S2O2溶液滴定剩余的I2( I2+2Na2S2O2=2NaI+Na2S4O6) ,加入淀粉溶液,滴定至终点时消耗Na2S2O2溶液V2mL。
“步骤3”加入盐酸的目的_________(用离子方程式说明)。
“步骤4”滴定至终点时的颜色变化是________。
③产品中(NH2)2CS的质量分数为_______ (列出计算式)。
【答案】-2 NH4SCN ![]() 2CaCN2+Ca(HS)2+6H2O=2(NH2)2CS+3Ca(OH)2 IO-+I-+2H+=I2+H2O 由蓝色变为无色
2CaCN2+Ca(HS)2+6H2O=2(NH2)2CS+3Ca(OH)2 IO-+I-+2H+=I2+H2O 由蓝色变为无色 
【解析】
(3)石灰乳和H2S反应得Ca(HS)2和H2O,CaCN2、Ca(HS)2和H2O反应得(NH2)2CS和Ca(OH)2,冷却、分离得(NH2)2CS产品,Ca(OH)2循环使用;
NaOH溶液和I2反应得NaIO和NaI,样品溶液中(NH2)2CS和NaIO反应,由于NaOH的具体量没给,所以存在NaIO未完全反应的可能,加HCl将NaIO“还原”为I2(由IO-+I-+2H+=I2+H2O可知,NaIO和I2的物质的量之比=1:1,该步得到的I2的物质的量和未反应的NaIO的物质的量相等),用Na2S2O2溶液反滴定剩余的I2。通过消耗Na2S2O2的量计算剩余的I2,I2的总物质的量减去剩余的I2即为“步骤2”消耗的I2,再根据4I2~4NaIO~(NH2)2CS计算(NH2)2CS的质量,从而计算(NH2)2CS的质量分数。
(1)S和C形成双键,S应显-2价,能与FeCl3溶液发生显色反应的化合物要么含有酚羟基,要么含有SCN-,结合硫脲分子的组成可知,该化合物应为NH4SCN,故答案为:-2;NH4SCN;
(2)每个H原子形成1对共用电子,每个N原子形成3对共用电子,每个C原子形成4对共用电子,所以氨基腈的电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
(3)①由图可知,反应物为CaCN2、Ca(HS)2、H2O,生成物为(NH2)2CS、Ca(OH)2,所以反应Ⅱ的化学方程式为2CaCN2+Ca(HS)2+6H2O=2(NH2)2CS+3Ca(OH)2,故答案为:2CaCN2+Ca(HS)2+6H2O=2(NH2)2CS+3Ca(OH)2;
②“步骤2”后,有一部分NaIO可能有剩余,这样会使测定结果偏大,“步骤3”加HCl的目的是将未反应的NaIO转化为I2,反应的离子方程式为:IO-+I-+2H+=I2+H2O。“步骤4” 用标准Na2S2O2溶液滴定溶液中的I2,以淀粉为指示剂,滴定终点前,溶液中有I2,溶液为蓝色,滴定至终点时,溶液中I2被消耗完,溶液由蓝色变为无色,且30s内不恢复蓝色,故答案为:IO-+I-+2H+=I2+H2O;由蓝色变为无色;
③结合I2+2Na2S2O2=2NaI+Na2S4O6可知,和Na2S2O2反应的I2的物质的量=![]() mol,“步骤2”消耗的I2的物质的量=
mol,“步骤2”消耗的I2的物质的量=![]() mol,由2NaOH+I2=NaIO+NaI+H2O,4NaIO+(NH2)2CS+H2O =(NH2)2CO+4NaI+H2SO2可知:4I2~4NaIO~(NH2)2CS,所以,溶液中(NH2)2CS的物质的量=
mol,由2NaOH+I2=NaIO+NaI+H2O,4NaIO+(NH2)2CS+H2O =(NH2)2CO+4NaI+H2SO2可知:4I2~4NaIO~(NH2)2CS,所以,溶液中(NH2)2CS的物质的量=![]() mol。则样品中(NH2)2CS的质量=
mol。则样品中(NH2)2CS的质量=![]() ×76×
×76×![]() g,所以该样品中(NH2)2CS的质量分数=
g,所以该样品中(NH2)2CS的质量分数=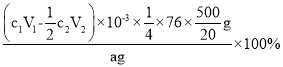 =
=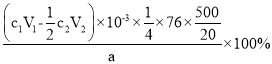 ,故答案为:
,故答案为: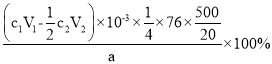 。
。

【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
【题目】工业上常用PCl5作为制造乙酰纤维素的催化剂,也常用于手性药品的研发,在材料,医药工业得到了广泛应用,请回答下列问题:
(1)PCl5在固态是离子化合物,相对式量为417,其阳离子为![]() ,则阴离子的化学式为_______。
,则阴离子的化学式为_______。
(2)已知: P(s) + ![]() Cl2(g) = PCl3(g) H= -306 KJ/mol
Cl2(g) = PCl3(g) H= -306 KJ/mol
PCl5(g) = PCl3(g) + Cl2(g) H= + 93 KJ/mol
则反应2P(s) + 5Cl2(g) = 2PCl5(g)的H=______kJ/mol。
(3)温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,容器中发生反应:PCl5(g)PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
t/min | 0 | 10 | 20 | 30 | 40 |
n(PCl3)/mol | 0 | 0.12 | 0.17 | 0.2 | 0.2 |
①反应在前10min的平均速率v(PCl5)=_______;
②不能表明该反应达到平衡状态的是:____ (选填序号);
a.容器的总压强不再改变
b.混合气体的平均相对分子质量不变
c.v正(PCl3)等于v逆(Cl2)
d.混合气体的密度不变
e.PCl5的质量不再变化
③要提高上述反应的转化率,可采取的措施有(至少两种)___________;
④该温度下,反应PCl5(g)PCl3(g) + Cl2(g)的平衡常数Kp=2.25×105(Kp为压强平衡常数,Kp=![]() )。把一定量的PCl5引入一真空瓶内,达平衡后PCl5的分压为2.5×104Pa,则PCl5的分解率为________。
)。把一定量的PCl5引入一真空瓶内,达平衡后PCl5的分压为2.5×104Pa,则PCl5的分解率为________。
(4)在热水中,五氯化磷完全水解,生成磷酸和盐酸。若将0.01molPCl5投入热水中配成lL溶液,再逐滴加入AgNO3溶液,先产生的沉淀是_____。 [已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10]。