题目内容
8.某芳香烃A有如下转化关系:
按要求填空:
(1)写出D中所含官能团的名称醛基、羟基,指出⑤的反应类型消去反应.
(2)反应②的反应条件是KOH水溶液,加热
(3)写出A和F结构简式:A
 ;F
;F
(4)写出反应③对应的化学方程式:2
 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2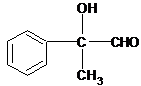 +2H2O
+2H2O(5)写出D与新制Cu(OH)2悬浊液反应的化学方程式:
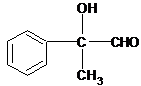 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O
+Cu2O↓+2H2O(6)E符合下列条件的同分异构体有多种,任写其中一种能同时满足下列条件的异构体的结构简式
 .
.a.苯环上的一氯代物有两种
b.遇FeCl3溶液发生显色反应
c.能与Br2/CCl4发生加成反应.
分析 D与新制备氢氧化铜反应产物可知D应为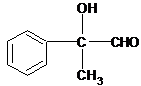

 ,则A为
,则A为

 ,据此分析解答.
,据此分析解答.
解答 解:D与新制备氢氧化铜反应产物可知D应为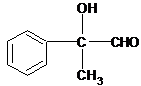

 ,则A为
,则A为

 ,
,
(1)D为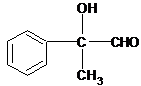
(2)C为
 ,B和KOH的水溶液加热发生消去反应生成C,所以反应条件是KOH水溶液、加热,故答案为:KOH水溶液,加热;
,B和KOH的水溶液加热发生消去反应生成C,所以反应条件是KOH水溶液、加热,故答案为:KOH水溶液,加热;
(3)为



(4)反应③为
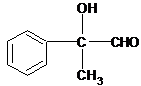

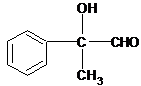
故答案为:2
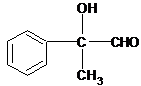
(5)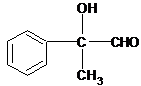
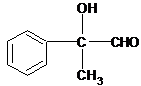
 +Cu2O↓+2H2O,
+Cu2O↓+2H2O,
故答案为: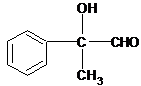
 +Cu2O↓+2H2O;
+Cu2O↓+2H2O;
(6)E为 ,E的同分异构体符合下列条件:
,E的同分异构体符合下列条件:
a.苯环上的一氯代物有两种,说明苯环上含有两种氢原子;
b.遇FeCl3溶液发生显色反应说明含有酚羟基,
c.能与Br2/CCl4发生加成反应说明含有碳碳双键,
符合条件的同分异构体结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,根据已知某些物质的结构简式、分子式及反应条件采用正逆结合的方法进行推断,难点是同分异构体判断,题目难度中等.

练习册系列答案
相关题目
18.利用Na2S2O8产生的强氧化性SO4-•(自由基)降解有机污染物是目前最具潜力的高级氧化技术.文献报道某课题组探究pH,单质铁和Na2S2O8的浓度对降解2,4-DMAP(2,4--甲基苯酚)效率的影响.
(1)探究溶液酸碱性的影响:将等量的2,4-DMAP加入到不同pH的Na2S2O8溶液中,结果如图1所示.由此可知:溶液酸性增强,有利于 (填“有利于”或“不利于”)Na2S2O8产生SO4-•.
(2)探究铁粉用量的影响:
①实验前,先用0.1mol•L-1 H2SO4洗涤Fe粉,其目的是去除铁粉表面的氧化物等杂质,后用蒸馏水洗涤至中性;
②相同条件下,取不同量处理后的铁粉分别加入c(2,4-DMAP)=1.0×10 -3mol•L-1、c(Na2S2O8)=4.2×10-3mol•L-1的混合溶液中,实验结果如图2所示.其中降解效率最好的铁粉用量是1.5g/L;计算从反应开始到A点时,2,4-DMAP降解的平均反应速率为2.0×10-5mol/(L•min)(忽略反应过程中溶液总质量变化).
③已知:2Fe+O2+2H2O=2Fe2++4OH-,S2O8-+Fe2+=SO4-+SO42-+Fe3+此外还可能会发生:SO4-+Fe2+=SO42-+Fe3+.当铁粉加入量过大时,2,4-DMAP的降解率反而下降,原因可能是(用离子方程式表示).Fe+2Fe3+=3Fe2+,SO4-+Fe2+=SO42-+Fe3+.
(3)探究Na2S2O8浓度的影响:填写下表中空格,完成实验方案.
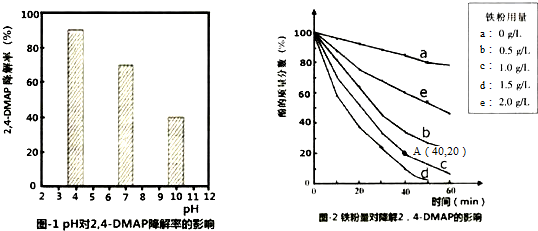
(1)探究溶液酸碱性的影响:将等量的2,4-DMAP加入到不同pH的Na2S2O8溶液中,结果如图1所示.由此可知:溶液酸性增强,有利于 (填“有利于”或“不利于”)Na2S2O8产生SO4-•.
(2)探究铁粉用量的影响:
①实验前,先用0.1mol•L-1 H2SO4洗涤Fe粉,其目的是去除铁粉表面的氧化物等杂质,后用蒸馏水洗涤至中性;
②相同条件下,取不同量处理后的铁粉分别加入c(2,4-DMAP)=1.0×10 -3mol•L-1、c(Na2S2O8)=4.2×10-3mol•L-1的混合溶液中,实验结果如图2所示.其中降解效率最好的铁粉用量是1.5g/L;计算从反应开始到A点时,2,4-DMAP降解的平均反应速率为2.0×10-5mol/(L•min)(忽略反应过程中溶液总质量变化).
③已知:2Fe+O2+2H2O=2Fe2++4OH-,S2O8-+Fe2+=SO4-+SO42-+Fe3+此外还可能会发生:SO4-+Fe2+=SO42-+Fe3+.当铁粉加入量过大时,2,4-DMAP的降解率反而下降,原因可能是(用离子方程式表示).Fe+2Fe3+=3Fe2+,SO4-+Fe2+=SO42-+Fe3+.
(3)探究Na2S2O8浓度的影响:填写下表中空格,完成实验方案.
| 序号、物理量 | M(Fe粉)/g | V[0.05mol.L-1Na2S2O8]/mL | V[H2O]/mL | 收集数据和得出结论 | |
| 1 | 100 | 0.3 | 50 | 50 | |
| 2 | 100V(污水)/mL | 0.3 |

16.下列物质中,只含离子键的是( )
| A. | NaOH | B. | KCl | C. | NH3 | D. | HCl |
3.氯化钙(CaCl2)是一种很好的道路融雪剂、防冻剂和防尘剂,对路面和路基有良好的养护作用.下列叙述一定能说明CaCl2是离子晶体的是( )
| A. | CaCl2固体不导电,但在熔融状态下可以导电 | |
| B. | CaCl2的水溶液能导电 | |
| C. | CaCl2易溶于水 | |
| D. | CaCl2在有机溶剂(如苯)中的溶解度极小 |
20.将一定质量的镁、铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物全部是NO).向反应后的溶液中加入3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加7.65g,则下列叙述中正确的是( )
| A. | 当生成沉淀达到最大量时,消耗NaOH溶液的体积为150mL | |
| B. | 当金属全部溶解时收集到NO气体的体积为0.336L(标准状况下) | |
| C. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.6mol | |
| D. | 参加反应的金属的总质量一定是9.9g |
18.现有三种元素的基态原子的电子排布式如下:①1s22s22p63s1②1s22s22p63s23p5;③1s22s22p5.则下列有关比较中正确的是( )
| A. | 第一电离能:②>③ | B. | 电负性:③>② | ||
| C. | 晶格能:NaCl>NaF | D. | 最高正化合价:③>① |
 如图所示,用排饱和食盐水法先后收集20ml CH4和 80mlCl2,放在光亮的地方(注意:不要放在日光直射的地方,以免引起爆炸),等待片刻,观察发生的现象.回答下列问题:
如图所示,用排饱和食盐水法先后收集20ml CH4和 80mlCl2,放在光亮的地方(注意:不要放在日光直射的地方,以免引起爆炸),等待片刻,观察发生的现象.回答下列问题: ,其化学键的类型为离子键、共价键.
,其化学键的类型为离子键、共价键.