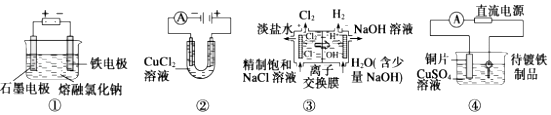
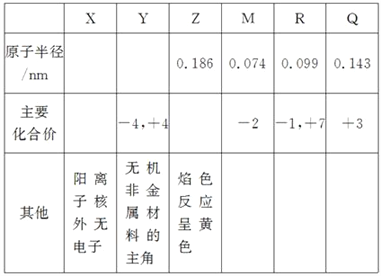
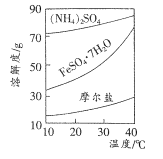
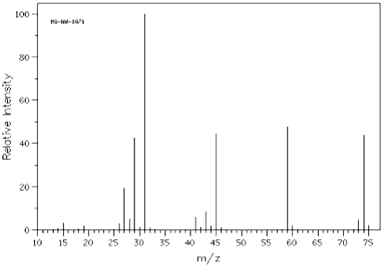
题目内容
【题目】根据题意填空:
(1)碳酸钠溶液中各离子按照浓度从大到小的顺序依次为: .
(2)下表是几种常见弱酸的电离平衡常数(25℃)
酸 | H2CO3 | CH3COOH | HClO |
K | K1=4.4×10﹣7;K 2=4.7×10﹣11 | K=1.76×10﹣5 | K=2.95×10﹣8 |
根据分析表格中数据可知,H2CO3、CH3COOH、HClO 三种酸的酸性从强到弱依次是;25℃时,等浓度的Na2CO3、NaAc 和NaClO三种溶液的pH从小到大依次是 .
(3)常温下,将0.02molL﹣1 的 Ba(OH)2溶液100mL和0.02molL﹣1的NaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液的 pH 为 .
(4)25℃时,Ksp[Mg(OH)2]=5.61×10﹣12 , Ksp[MgF2]=7.42×10﹣11 . 该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比,(填化学式)溶液中的 c(Mg2+)大.
【答案】
(1)c(Na+)>c(CO32﹣)>c(OH﹣)>c(HCO3﹣)>c(H+)
(2)CH3COOH>H2CO3>HClO; NaAc<NaClO<Na2CO3
(3)12
(4)MgF2
【解析】解:(1)碳酸钠溶液中碳酸根离子分步水解溶液显碱性,离子浓度大小为:c(Na+)>c(CO32﹣)>c(OH﹣)>c(HCO3﹣)>c(H+),
所以答案是:c(Na+)>c(CO32﹣)>c(OH﹣)>c(HCO3﹣)>c(H+);(2)电离平衡常数越大酸性越强,图表中可知:电离平衡常数CH3COOH>H2CO3>HClO>HCO3﹣,酸性越弱对应盐水解程度越大,对应盐的水解程度Na2CO3>NaClO>NaAc,
所以答案是:CH3COOH>H2CO3>HClO;NaAc<NaClO<Na2CO3;(3)100mL 0.02molL﹣1的Ba(OH)2溶液中氢氧化钡物质的量为:0.02molL﹣1×0.1L=0.002mol,氢氧根的物质的量为0.004mol;
100mL 0.02molL﹣1的NaHSO4溶液中硫酸氢钠的物质的量为:0.02molL﹣1×0.1L=0.002mol,氢离子的物质的量为:0.002mol;
A.两溶液混合后,氢氧根离子过量,溶液显示碱性,反应后的溶液中氢氧根离子浓度为: ![]() =0.01mol/L,溶液的pH=12
=0.01mol/L,溶液的pH=12
所以答案是:12;(4)因氢氧化镁溶度积小,由Ksp计算则其Mg2+浓度小,该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比,MgF2溶液中的 c(Mg2+)大,
所以答案是:MgF2.

 黄冈创优卷系列答案
黄冈创优卷系列答案