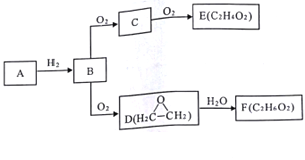
题目内容
【题目】X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
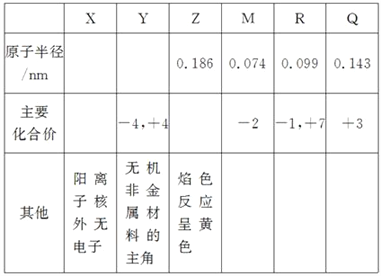
(1)R在元素周期表中的位置是________;R在自然界中有质量数为35和37的两种核素,它们之间的关系为______________________。
(2)Z的单质与水反应的化学方程式为______________________。
(3)Y与R相比,非金属性较强的是________(用元素符号表示),下列事实能证明这一结论的是________________________。
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性:XR>YX4
c.最高价氧化物对应的水化物的酸性:HRO4>H2YO3
(4)根据表中数据推测Y的原子半径的范围:________nm<rY<________nm。___________________
(5)甲、乙是上述部分元素的最高价氧化物对应的水化物,且甲+乙―→丙+水,则丙的化学式为________________________(写出一种即可)。
【答案】 第三周期第ⅦA族 互为同位素 2Na+2H2O===2NaOH+H2↑ Cl bc 0.099;0.143 NaAlO2(Na2SiO3或NaClO4)
【解析】X、Y、Z、M、R、Q是短周期主族元素,X阳离子核外无电子,则X为H元素;Y的化合价主要为-4,+4,是无机非金属材料的主角,则Y为Si元素;Z焰色反应呈黄色,则Z为Na元素;R的主要化合价为-1,+7,则R为Cl元素;Q主要化合价为+3价,原子半径Na>Q>Cl,则Q为Al元素;M的主要化合价为-2价,为第ⅥA族元素,原子半径M<Cl,则M为O元素,即X为H元素;Y为Si元素;Z为Na元素;R为Cl元素;Q为Al元素;M为O元素。
(1)R为Cl元素,核外有17个电子,核外电子排布为2、8、7,所以Cl元素处于第三周期ⅦA族;R在自然界中有质量数为35和37的两种核素,中子数不同,二者互为同位素;(2)Z为Na元素,钠与水反应生成氢氧化钠和氢气,反应方程式为2Na+2H2O=2NaOH+H2↑;(3)Y为Si元素,R为Cl元素;同周期自左而右,非金属性减弱,所以非金属性Si<Cl;a.常温下Y的单质呈固态,R的单质呈气态,状态不能说明元素的非金属性强弱,选项a错误;b.非金属越强,氢化物越稳定,稳定性XR>YX4,说明X的非金属性强,选项b正确;c.Y与R形成的化合物中Y呈正价,说明X吸引电子能力强,X的非金属性强,选项c正确。答案选项bc;(4)Y为Si元素,同周期自左而右,原子半径减小,所以原子半径Al>Si>Cl,即大于0.099nm小于0.143nm;(5)Y为Si元素;Z为Na元素;R为Cl元素;Q为Al元素;其高价氧化物的水化物,分别为硅酸、氢氧化钠、高氯酸、氢氧化铝。甲+乙→丙+水,丙为盐,丙的水溶液呈碱性,则丙为强碱弱酸盐,则丙为NaAlO2 或Na2SiO3。

【题目】根据题意填空:
(1)碳酸钠溶液中各离子按照浓度从大到小的顺序依次为: .
(2)下表是几种常见弱酸的电离平衡常数(25℃)
酸 | H2CO3 | CH3COOH | HClO |
K | K1=4.4×10﹣7;K 2=4.7×10﹣11 | K=1.76×10﹣5 | K=2.95×10﹣8 |
根据分析表格中数据可知,H2CO3、CH3COOH、HClO 三种酸的酸性从强到弱依次是;25℃时,等浓度的Na2CO3、NaAc 和NaClO三种溶液的pH从小到大依次是 .
(3)常温下,将0.02molL﹣1 的 Ba(OH)2溶液100mL和0.02molL﹣1的NaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液的 pH 为 .
(4)25℃时,Ksp[Mg(OH)2]=5.61×10﹣12 , Ksp[MgF2]=7.42×10﹣11 . 该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比,(填化学式)溶液中的 c(Mg2+)大.