题目内容
【题目】观察下列几个装置示意图,有关叙述正确的是( ) 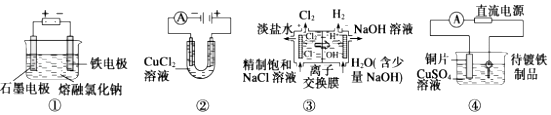
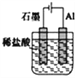
A.装置①工业上可用于生产金属钠,电解过程中石墨电极产生金属
B.装置②中阳极产生的气体可以使湿润的淀粉碘化钾试纸变蓝
C.装置③中的离子交换膜允许阳离子、阴离子和小分子水通过
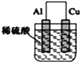
D.装置④的待镀铁制品应与电源正极相连
【答案】B
【解析】解:A.装置①中阴极上金属离子放电生成单质,即金属单质在铁电极上生成,故A错误;
B.装置②中氯离子在阳极失电子,生成氯气,氯气能使湿润的淀粉碘化钾试纸变蓝,故B正确;
C.离子交换膜只允许离子和分子通过,而图中应是阳离子交换膜,所以只允许阳离子和水分子通过,而不允许阴离子氢氧根离子通,故C错误;
D.装置③中,电镀池中,镀层作电解池阳极,待镀金属作阴极,则待镀铁制品应与电源负极相连,故D错误;
故选B.

【题目】根据题意填空:
(1)碳酸钠溶液中各离子按照浓度从大到小的顺序依次为: .
(2)下表是几种常见弱酸的电离平衡常数(25℃)
酸 | H2CO3 | CH3COOH | HClO |
K | K1=4.4×10﹣7;K 2=4.7×10﹣11 | K=1.76×10﹣5 | K=2.95×10﹣8 |
根据分析表格中数据可知,H2CO3、CH3COOH、HClO 三种酸的酸性从强到弱依次是;25℃时,等浓度的Na2CO3、NaAc 和NaClO三种溶液的pH从小到大依次是 .
(3)常温下,将0.02molL﹣1 的 Ba(OH)2溶液100mL和0.02molL﹣1的NaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液的 pH 为 .
(4)25℃时,Ksp[Mg(OH)2]=5.61×10﹣12 , Ksp[MgF2]=7.42×10﹣11 . 该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比,(填化学式)溶液中的 c(Mg2+)大.