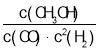题目内容
【题目】下列离子方程式正确的是( )
A. 碳酸的电离:H2CO3![]() H+ +HCO3-
H+ +HCO3-
B. 将金属钠放入水中:Na+2H2O = Na+ +2OH-+H2↑
C. 碳酸钠水解:CO32-+2H2O = H2CO3+2OH-
D. 向氯化铝溶液中加入过量的烧碱溶液:Al3+ +3OH-= Al(OH)3↓
【答案】A
【解析】
A. 碳酸的电离方程式为H2CO3![]() H+ + HCO3-,A项正确;
H+ + HCO3-,A项正确;
B. 将金属钠放入水中的离子反应为2Na+2H2O=2Na+ +2OH-+H2↑,B项错误;
C. 碳酸钠水解的离子反应为CO32+H2O![]() HCO3+OH,C项错误;
HCO3+OH,C项错误;
D. 向氯化铝溶液中加入过量的烧碱溶液的离子反应为Al3++4OH=AlO2+2H2O,D项错误;
答案选A。

 名校课堂系列答案
名校课堂系列答案【题目】(1)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中从反应开始至平衡以CO2表示的平均反应速率为v(CO2)=____(取小数点后两位,下同)。
②该反应的正反应为___(填“吸”或“放”)热反应,实验2条件下平衡常数K=___。
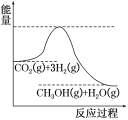
(2)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,达到平衡后下列措施中能使c(CH3OH)增大的是____。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,达到平衡后下列措施中能使c(CH3OH)增大的是____。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1 mol CO2和3 mol H2
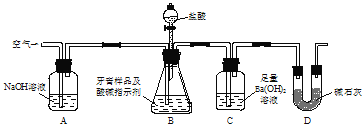
【题目】除去下列物质中所含杂质(括号中的物质)所选用的试剂和装置均正确的是 ( )
Ⅰ.试剂:①KMnO4/H+②NaOH溶液 ③饱和Na2CO3溶液④H2O ⑤Na ⑥Br2/H2O ⑦Br2/CCl4
Ⅱ.装置:

选项 | 物质 | 试剂 | 装置 |
A | C2H6(C2H4) | ⑥ | ① |
B | 苯(苯酚) | ① | ③ |
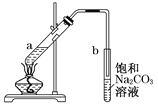
C | CH3COOC2H5(CH3COOH) | ③ | ② |
D | 甲苯(二甲苯) | ① | ③ |