题目内容
【题目】绿矾(FeSO4·7H2O)在工业上可用于制造铁盐、氧化铁红及靛青等。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

25℃ | pH值 |
饱和H2S溶液 | 3.9 |
SnS沉淀完全 | 1.6 |
FeS开始沉淀 | 3.0 |
FeS开始沉淀 | 5.5 |
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为________。
A.KSCN溶液 B.NaOH溶液 C.KMnO4溶液 D.苯酚溶液
(2)操作Ⅱ中,通入硫化氢至饱和的目的是______________________________________;在溶液中用硫酸酸化至pH=2的目的是__________________________________。
(3)操作Ⅳ的顺序依次为_________________、冷却结晶、____________________。
(4)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②_________________________________________________________。
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.850 g绿矾产品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用硫酸酸化的0.010 00 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①滴定时盛放KMnO4溶液的仪器为________________________(填仪器名称)。
②计算上述样品中FeSO4·7H2O的质量分数为____________________。
【答案】AD 除去溶液中的Sn2+离子,并防止Fe2+被氧化 防止Fe2+离子生成沉淀 蒸发浓缩 过滤洗涤 降低洗涤过程中FeSO4·7H2O的损耗 酸式滴定管 0.975
【解析】
(1)依据三价铁离子的检验方法分析回答,三价铁离子遇硫氰化钾溶液变血红色;遇苯酚呈紫色溶液;
(2)依据流程关系图分析,通入硫化氢制饱和,目的是沉淀锡离子,硫化氢是强还原剂,防止亚铁离子被氧化;在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,操作Ⅱ加入稀硫酸调节溶液pH=2防止Fe2+形成沉淀;
(3)操作IV的目的是从滤液中析出绿矾晶体,利用蒸发浓缩,冷却结晶、过滤洗涤得到晶体;
(4)操作IV得到的绿矾晶体用少量冰水洗涤目的是洗去表面杂质,温度降低绿矾溶解度降低,减少绿矾晶体的损失;
(5)①高锰酸钾溶液具有强氧化性能氧化橡胶管,不能用碱式滴定管;
②依据滴定实验的反应终点时发生的反应进行计算。
(1)检验所得绿矾晶体中是否含有Fe3+的实验操作是利用三价铁离子检验方法分析,三价铁离子遇SCN-离子会反应生成硫氰化铁血红色溶液,证明铁离子的存在;遇苯酚溶液呈紫色。
A、KSCN溶液和三价铁离子反应生成血红色溶液,可以检验铁离子的检验,选项A符合;
B、NaOH溶液和亚铁离子反应生成白色沉淀迅速变为灰绿色最后变为红褐色,和铁离子反应生成红褐色沉淀,不能检验铁离子的存在,选项B不符合;
C、KMnO4溶液不与铁离子反应,紫红色褪为无色只能证明存在Fe2+,选项C不符合;
D、苯酚溶液和铁离子反应生成紫色溶液,可以检验铁离子的存在,选项D符合;
故答案为:AD;
(2)通入硫化氢至饱和的目的是:目的是沉淀锡离子,同时硫化氢具有强还原性,可以防止亚铁离子被氧化;已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是,在溶液pH=2时,Sn2+完全沉淀,亚铁离子不沉淀,故答案为:除去溶液中的Sn2+离子,并防止Fe2+被氧化;防止Fe2+离子生成沉淀;
(3)溶液中得到晶体,需要对溶液进行蒸发浓缩,冷却结晶,过滤洗涤等,所以操作IV的顺序依次为:蒸发浓缩、冷却结晶、过滤、洗涤,故答案为:蒸发浓缩;过滤洗涤;
(4)冰水温度低,物质溶解度减小,可以洗去沉淀表面的杂质离子,避免绿矾溶解带来的损失,故答案为:降低洗涤过程中FeSO4·7H2O的损耗;
(5)①高锰酸钾溶液具有强氧化性能氧化橡胶管,不能用碱式滴定管,用酸式滴定管,故答案为:酸式滴定管;
②a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL,则
5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.01000mol/L×0.0200L
计算得到;n(Fe2+)=0.001mol;
则250mL溶液中含Fe2+=0.001mol×![]() =0.01mol;
=0.01mol;
FeSO4·7H2O物质的量为0.01mol,质量=0.01mol×278g/mol=2.78g;
质量分数=![]() ×100%=97.5%。
×100%=97.5%。

 阅读快车系列答案
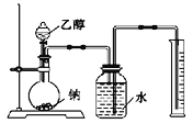
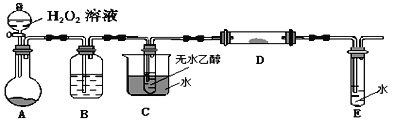
阅读快车系列答案【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸,D中放有饱和碳酸钠溶液。

已知:①无水氯化钙可与乙醇形成微溶于水的CaCl2·6C2H5OH;
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用为__________,圆底烧瓶中发生的化学反应方程式:_________。
(2)球形干燥管C的作用是_________,反应结束后D中的现象是_______________。
(3)该小组同学在实验时加入过量的乙醇,目的是_________________。
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出____________;再加入(此空从下列选项中选择)________;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰