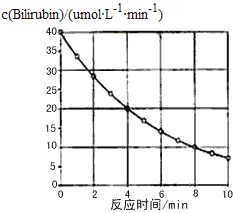
题目内容
【题目】向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/LBa(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是
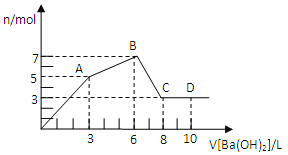
A. 原混合液中c(SO42-):c(Cl-)=1:1
B. 向D点溶液中通入C02气体,立即产生白色沉淀
C. 图中A点沉淀中含有BaSO4和Al(OH)3
D. AB段反应的离子方程式为:Al3++3OH-=Al(OH)3↓
【答案】A
【解析】
Al2(SO4)3和AlCl3的混合溶液与Ba(OH)2溶液反应的实质是Al3+与OH-、Ba2+与SO42-之间的离子反应,反应如下:Ba2++SO42-=BaSO4↓,Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O,假设1molAl2(SO4)3中SO42-完全被沉淀所需Ba(OH)2量为3mol,提供6molOH-,1molAl2(SO4)3中含有2molAl3+,由反应Al3++3OH-=Al(OH)3↓可知,2molAl3+完全沉淀,需要6molOH-,故从起点到A点,可以认为是硫酸铝与氢氧化钡恰好发生反应生成硫酸钡、氢氧化铝沉淀,A点时SO42-完全沉淀,A~B为氯化铝与氢氧化钡的反应,B点时溶液中Al3+完全沉淀,产生沉淀达最大值,溶液中溶质为BaCl2,B~C为氢氧化铝与氢氧化钡反应,C点时氢氧化铝完全溶解。则可依次分析四个选项如下:
A、前3LBa(OH)2溶液与溶液中Al2(SO4)3反应,从3L~6L为Ba(OH)2溶液与溶液中AlCl3反应,二者消耗的氢氧化钡的物质的量相等为3L×1mol/L=3mol,由生成硫酸钡可知3n[Al2(SO4)3]=n[Ba(OH)2],故n[Al2(SO4)3]=1mol,由氯化铝与氢氧化钡生成氢氧化铝可知3n(AlCl3)=2[Ba(OH)2]=6mol,故n(AlCl3)=2mol,因此原溶液中c[Al2(SO4)3]:c(AlCl3)=1:2,即c(SO42-):c(Cl-)=1:2,故A错误;
B、D点的溶液中含有大量的OH-、Ba2+、AlO2-,通入二氧化碳立即产生碳酸钡沉淀,通入足量的二氧化碳后还能生成氢氧化铝沉淀,B正确;
C、根据以上分析可知图中A点沉淀中含有BaSO4和Al(OH)3,C正确;
D、根据以上分析可知AB段反应的离子方程式为Al3++3OH-=Al(OH)3↓,D正确;
答案选A。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案【题目】绿矾(FeSO4·7H2O)在工业上可用于制造铁盐、氧化铁红及靛青等。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

25℃ | pH值 |
饱和H2S溶液 | 3.9 |
SnS沉淀完全 | 1.6 |
FeS开始沉淀 | 3.0 |
FeS开始沉淀 | 5.5 |
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为________。
A.KSCN溶液 B.NaOH溶液 C.KMnO4溶液 D.苯酚溶液
(2)操作Ⅱ中,通入硫化氢至饱和的目的是______________________________________;在溶液中用硫酸酸化至pH=2的目的是__________________________________。
(3)操作Ⅳ的顺序依次为_________________、冷却结晶、____________________。
(4)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②_________________________________________________________。
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.850 g绿矾产品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用硫酸酸化的0.010 00 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①滴定时盛放KMnO4溶液的仪器为________________________(填仪器名称)。
②计算上述样品中FeSO4·7H2O的质量分数为____________________。