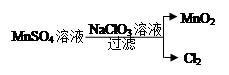题目内容
氧化还原反应中实际上包含氧化和还原两个过程,下面是一个还原过程的反应式:NO3-+4H++3e-=NO+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的化学方程式:________________________。
(2)反应中硝酸体现了________、________的性质。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是________mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是_________________________________________________________________。
(1)14HNO3(稀)+3Cu2O=6Cu(NO3)2+2NO↑+7H2O。 (2)酸性 氧化性 (3)0.6(4)使用了较浓的硝酸,产物中有部分二氧化氮生成
解析

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案(14分)Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第 周期第 族;S的基态原子核外有 个未成对电子;Si的基态原子核外电子排布式为 。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si S | O2- Na+ | NaCl Si | H2SO4 HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101KPa下,已知该反应每消耗1 mol CuCl2(s),放热44.4KJ,该反应的热化学方程式是 。
(4)ClO2是常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目 。
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:
氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-=5I-+IO3-+3H2O
KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是 (用化学式表示);CCl4中显紫红色的物质是 (用电子式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为 、 。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式: 。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适? (填“是”或“否”),并说明理由: 。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是 。
| A.Na2S2O3 | B.AlCl3 |
| C.Na2CO3 | D.NaNO2 |
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH、Ba2+、Al3+、Fe3+、Cl-、SO42-、CO32-,将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
| 序号 | 实验内容 | 实验结果 |
| 1 | 加过量盐酸 | 无气体产生 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体1.12 L(已折算成标准状况下的体积),并有红褐色沉淀生成,将沉淀过滤洗涤、干燥、灼烧,称重得1.60 g固体。 |
| 3 | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量 | 第一次称量读数为2.33 g |
试回答下列问题:
(1)根据实验1对CO32-是否存在的判断是________,(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 | 物质的量浓度(mol·L-1) |
| | |
| | |
| | |
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 | Cl- CO32— NO3— SO42— I- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是___________________________________。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是________________________。
(3)甲同学最终确定原溶液中所含阳离子有________,阴离子有________;并据此推测原溶液应该呈________性,原因是____________________________(请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为____________________________。充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为________g。